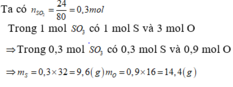Tìm khối lượng mỗi nguyên tố trong 24g Fe2O3
HV
Những câu hỏi liên quan
Một hợp chất X có thành phần phần trăm khối lượng mỗi nguyên tố là : %S=40% và %O=60%
Hãy tính khối lượng mỗi nguyên tố có trong 24g hợp chất X.
tính phần trăm khối lượng của mỗi nguyên tố trong Fe2O3
tính khối lượng của mỗi nguyên tố trong Fe2O3
\(a.\%Fe=\dfrac{112}{160}=70\%\\ \%O=100\%-70\%=30\%\\ b.m_{Fe}=56.2=112\left(g\right)\\ m_O=16.3=48\left(g\right)\)
Đúng 5
Bình luận (1)
Khối lượng của mỗi nguyên tố có trong 0,5 mol NaHCO3 lần lượt là:
A)11,5g Na; 5g H; 6g C; 24g O
B) 11,5g Na; 0,5g H; 0,6g C; 24g O
C) 11,5g Na; 0,5g H; 6g C; 24g O
D) 11,5g Na; 0,5g H; 6g C; 24g O.
Khối lượng của mỗi nguyên tố có trong 0,5 mol KHSO3 lần lượt là
19,5g K; 5g H; 32g S; 24g O
19,5g K; 0,5g H; 16g S; 24g O
19,5g K; 0,5g H; 6g S; 24g O
19,5g K; 5g H; 0,6g S; 24g O
giúp mình với. Cảm ơn các bạn!!
Cho 200 ml dd H2SO4 2M hòa tan vừa hết với 24g hỗn hợp CUO và Fe2O3.
Tính khối lượng mỗi oxit trong hỗn hợp
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: 80nCuO + 160nFe2O3 = 24 (1)
\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{CuO}+3n_{Fe_2O_3}=0,4\left(2\right)\)
Từ (1) và (2) ⇒ nCuO = nFe2O3 = 0,1 (mol)
⇒ mCuO = 0,1.80 = 8 (g)
mFe2O3 = 0,1.160 = 16 (g)
Đúng 2
Bình luận (0)
\(n_{CuO}=a\left(mol\right);n_{Fe_2O_3}=b\left(mol\right)\left(a,b>0\right)\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ \Rightarrow\left\{{}\begin{matrix}80a+160b=24\\a+3b=2.0,2=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \%m_{CuO}=\dfrac{0,1.80}{24}.100\%\approx33,333\%;\%m_{Fe_2O_3}=\dfrac{160.0,1}{24}.100\%\approx66,667\%\)
Đúng 0
Bình luận (0)
đổi `200ml=0,2l`
`=>n_(H_2 SO_4)=C_M *V=2*0,2=0,4(mol)`
gọi: \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_2O_3}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:CuO+H_2SO_4->CuSO_4+H_2O\)
tỉ lệ 1 : 1 : 1 : 1
n(mol) a----------->a---------->a------------>a
\(PTHH:Fe_2O_3+3H_2SO_4->Fe_2\left(SO_4\right)_3+3H_2O\)
tỉ lệ 1 ; 3 : 1 : 3
n(mol) b--------->3b------------>b-------------->3b
Ta có hệ phương trình sau
\(\left\{{}\begin{matrix}80a+160b=24\\a+3b=0,4\end{matrix}\right.\\ < =>\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ =>\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=0,1\left(mol\right)\end{matrix}\right.\\ =>\left\{{}\begin{matrix}m_{CuO}=n\cdot M=0,1\cdot80=8\left(g\right)\\m_{Fe_2O_3}=n\cdot M=0,1\cdot160=16\left(g\right)\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Tính khối lượng mỗi nguyên tố có trong:
a. 20 (g) sắt III sunfat
b. 6,72 lít khí C2H6O (ở đktc)
c. 25 (g) hỗn hợp Fe2O3 và MgO biết rằng khối lượng nguyên tố oxi trong hỗn hợp đó là 32%.
a) \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{20}{400}=0,05\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_S=0,15\left(mol\right)\\n_O=0,6\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_S=0,15.32=4,8\left(g\right)\\m_O=0,6.16=9,6\left(g\right)\end{matrix}\right.\)
b) \(n_{C_2H_6O}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_C=0,6\left(mol\right)\\n_H=1,8\left(mol\right)\\n_O=0,3\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_C=0,6.12=7,2\left(g\right)\\m_H=1,8.1=1,8\left(g\right)\\m_O=0,3.16=4,8\left(g\right)\end{matrix}\right.\)
c) Gọi số mol Fe2O3, MgO là a, b (mol)
=> 160a + 40b = 25
nO = 3a + b = \(\dfrac{25.32\%}{16}=0,5\) (mol)
=> a = 0,125 (mol); b = 0,125 (mol)
=> \(\left\{{}\begin{matrix}n_{Fe}=0,25\left(mol\right)\\n_{Mg}=0,125\left(mol\right)\\n_O=0,5\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Fe}=0,25.56=14\left(g\right)\\m_{Mg}=0,125.24=3\left(g\right)\\m_O=0,5.16=8\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (2)
a. Số mol sắt (III) sunfat Fe2(SO4)3 là 20/400=0,05 (mol).
mFe=0,05.2.56=5,6 (g), mS=0,05.3.32=4,8 (g), mO=0,05.3.4.16=9,6 (g).
b. Số mol khí C2H6O (ở đktc) là 6,72/22,4=0,3 (mol).
mC=0,3.2.12=7,2 (g), mH=0,3.6=1,8 (g), mO=0,3.16=4,8 (g).
c. Gọi x (mol) và y (mol) lần lượt là số mol của Fe2O3 và MgO.
160x+40y=25 (1).
\(\dfrac{3x.16+16y}{25}=32\%\) \(\Rightarrow\) 48x+16y=8 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra x=0,125 (mol) và y=0,125 (mol).
mFe=0,125.2.56=14 (g).
mMg=0,125.24=3 (g).
mO=(0,125.3+0,125).16=8 (g).
Đúng 1
Bình luận (2)
Cho 24g hỗn hợp gồm MgO,Fe2O3 vào 500ml dung dịch axit clohidric 2M.Tính khối lượng mỗi axit
\(n_{MgO}=a\left(mol\right),n_{Fe_2O_3}=b\left(mol\right)\)
\(m_{hh}=40a+160b=24\left(g\right)\left(1\right)\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(n_{HCl}=2a+6b=1\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.1\)
\(m_{MgO}=0.2\cdot40=8\left(g\right)\)
\(m_{Fe_2O_3}=16\left(g\right)\)
Đúng 1
Bình luận (0)
hòa tan hoàn toàn 24g hỗn hợp bột cuo và Fe2O3 vào 116,8g dd HCl 25%
tính thành phần % theo khối lượng mỗi Oxit trong hỗn hợp ban đầu
Pt : \(CuO+2HCl\rightarrow CuCl_2+H_2O|\)
1 2 1 1
a 2a
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O|\)
1 6 2 3
b 6b
Gọi a là số mol của CuO
b là số mol của Fe2O3
\(m_{CuO}+m_{Fe2O3}=24\left(g\right)\)
⇒ \(n_{CuO}.M_{CuO}+n_{Fe2O3}.M_{Fe2O3}=24g\)
⇒ 80a + 160b = 24g (1)
Ta có : \(m_{Ct}=\dfrac{25.116,8}{100}=29,2\left(g\right)\)
\(n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
⇒ 2a + 6b = 0,8(2)
Từ (1),(2) , ta có hệ phương trình :
80a + 260b = 24
2a + 6b = 0,4
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(m_{CuO}=0,1.80=8\left(g\right)\)
\(m_{Fe2O3}=0,1.160=16\left(g\right)\)
0/0CuO = \(\dfrac{8.100}{24}=33,33\)0/0
0/0Fe2O3 = \(\dfrac{16.100}{24}=66,67\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Cho 24g hỗn hợp X gồm Fe2O3 và CuO tác dụng vừa đủ với 8,96 lít H2(đktc). Tìm % khối lượng các oxit trong X?
Xem chi tiết
PTHH: Fe2O3 + 3 H2 -to-> 2 Fe +3 H2O
x____________3x_______2x(mol)
CuO + H2 -to-> Cu + H2O
y___y________y(mol)
Hệ pt:
\(\left\{{}\begin{matrix}160x+80y=24\\3x+y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
-> mCuO= 0,1.80=8(g)
-> %mCuO=(8/24).100 \(\approx\) 33,333%
-> %mFe2O3 \(\approx\) 66,667%
Đúng 1
Bình luận (0)