Cho hỗn hợp khí N2; NH3 với chất xúc tác thích hợp ở nhiệt độ t1 và áp suất p1. Sau một thời gian, giữ nguyên t1 thì áp suất bình là p2 khi hệ đạt tới cân bằng. So sánh p1 và p2:
A.p2<p1
B.p2=p1
C.p2<=p1
d.p2>p1
Hỗn hợp khí A gồm N2 và H2 có: dA/N2=0,35
a) Tìm % n2?%H2
b)Tìm %khối lượng của mỗi khí trong hỗn hợp
\(GS:n_A=1\left(mol\right)\)
\(n_{N_2}=a\left(mol\right),n_{H_2}=b\left(mol\right)\)
\(\Leftrightarrow a+b=1\left(1\right)\)
\(M_A=0.35\cdot28=9.8\left(\dfrac{g}{mol}\right)\)
\(m_A=9.8\cdot1=9.8\left(g\right)\)
\(\Leftrightarrow28a+2b=9.8\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.7\)
\(\%n_{N_2}=\dfrac{0.3}{1}\cdot100\%=30\%\)
\(\%n_{H_2}=70\%\)
\(\%m_{N_2}=\dfrac{0.3\cdot28}{9.6}\cdot100\%=87.5\%\)
\(\%m_{H_2}=12.5\%\)
\(\)
a) Gọi n N2 = a(mol) ; n H2 = b(mol)
Coi n A = 1(mol)
M A = 0,35.28 = 9,8 (g/mol)
Ta có :
a + b = 1
28a + 2b = 9,8.1
Suy ra a = 0,3 ; b = 0,7
%V N2 = 0,3/1 .100% = 30%
%V H2 = 0,7/1 .100% = 70%
b)
%m N2 = 0,3.28/9,8 . 100% = 85,71%
%m H2 = 100%- 85,71% = 14,29%
cho 11,2l khí H2 tác dụng với 11,2l khí N2 sau phản ứng kết thúc thu được 17,92l hỗn hợp N2 , H2, NH3 . Các khí phản ứng với nhau theo phản ứng
N2+3H2--->2NH3
a) Tính thể tích mỗi khí có trong hỗn hợp sau phản ứng
b) Tính hiệu suất của chúng
a) \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(n_{N_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: N2 + 3H2 --to,xt--> 2NH3
Xét tỉ lệ: \(\dfrac{0,5}{1}>\dfrac{0,5}{3}\) => Hiệu suất tính theo H2
Gọi số mol H2 pư là a (mol)
PTHH: N2 + 3H2 --to,xt--> 2NH3
Trc pư: 0,5 0,5 0
Pư: \(\dfrac{1}{3}a\)<-----------a----------->\(\dfrac{2}{3}a\)
Sau pư: \(\left(0,5-\dfrac{1}{3}a\right)\) (0,5-a) \(\dfrac{2}{3}a\)
=> \(\left(0,5-\dfrac{1}{3}a\right)+\left(0,5-a\right)+\dfrac{2}{3}a=\dfrac{17,92}{22,4}=0,8\)
=> a = 0,3 (mol)
=> hh khí sau pư gồm \(\left\{{}\begin{matrix}N_2:0,4\left(mol\right)\\H_2:0,2\left(mol\right)\\NH_3:0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}V_{N_2}=0,4.22,4=8,96\left(l\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\\V_{NH_3}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
b) \(H\%=\dfrac{0,3}{0,5}.100\%=60\%\)
I.Tỷ khối của 1 hỗn hợp khí N2 và H2 so với O2 là 0,3125 . Tìm thành phần % về thể tích của N2 và H2 có trong 29,12 l hỗn hợp khí (đktc)
II. cần lấy thêm bao nhiêu lít N2 vào 29,12 lít hỗn hợp khí trên để thu được 1 hỗn hợp khí mới có tỉ khối so với O2 là 0,46875 ( các khí đo ở điều kiện tiêu chuẩn)
\(I,M_{hh}=M_{O_2}.0,3125=32.0,3125=10\left(\dfrac{g}{mol}\right)\\ Đặt:n_{N_2}=a\left(\%\right)\\ \Rightarrow\dfrac{28a+2\left(100\%-a\right)}{100\%}=10\\ \Leftrightarrow a\approx30,769\%=\%n_{N_2}=\%V_{N_2}\\ \Rightarrow\%V_{H_2}\approx69,231\%\\ II,Đặt:n_{N_2\left(thêm\right)}=k\left(mol\right)\\ n_{hh}=\dfrac{29,12}{22,4}=1,3\left(mol\right)\\ M_{hh.khí.mới}=M_{O_2}.0,46875=32.0,46875=15\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{\left(k+0,13.0,30769\right).28+2.0,69231}{k+0,13}=15\\ \Leftrightarrow k=\left(ra.âm\right)\)
Nói chung làm được ý 1, anh thấy ý 2 ra âm. Em xem lại đề nha
Bài 1.
Gọi \(\left\{{}\begin{matrix}n_{N_2}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\dfrac{d_{N_2,H_2}}{M_{O_2}}=0,3125\Rightarrow d_{N_2,H_2}=0,3125\cdot32=10\)
Sơ đồ chéo:
\(N_2\) 28 8
\(10\)
\(H_2\) 2 18
\(\Rightarrow\dfrac{N_2}{H_2}=\dfrac{x}{y}=\dfrac{8}{18}=\dfrac{4}{9}\)\(\Rightarrow9x-4y=0\left(1\right)\)
Mà \(x+y=\dfrac{29,12}{22,4}=1,3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\\y=0,9\end{matrix}\right.\)
\(\%V_{N_2}=\dfrac{0,4}{0,4+0,9}\cdot100\%=30,77\%\)
\(\%V_{H_2}=100\%-30,77\%=69,23\%\)
cho 50l hỗn hợp khí X gồm N2 và H2 vào bình kín ( không có không khí ) . Tiến hành tổng hợp khí Amoniac ở điều khiện thích hợp : N2 + H2 --> NH3 . Sau một thời gian phản ứng đưa về điều kiện nhiệt độ , áp suất ban đầu thì thu được 44 lít hỗn hợp khí Y có 25% thể tích khí N2 . Thêm vào Y 6 lít N2O ở cùng điều kiện được hỗn hợp Z
a) Tính thành phần % theo thể tích từng khí trong X
b) Tính khối lượng của 11,2 lít hỗn hợp Z ở đktc
a) Giả sử các khí đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol N2, H2 ban đầu là a, b (mol)
=> a + b = 50 (1)
Gọi số mol N2 pư là x (mol)
PTHH: N2 + 3H2 --to,xt--> 2NH3
Trc pư: a b 0
Pư: x---->3x----------->2x
Sau pư (a-x) (b-3x) 2x
=> a + b - 2x = 44
=> x = 3 (mol)
Có \(n_{N_2\left(sau.pư\right)}=a-x=44.25\%=11\left(mol\right)\)
=> a = 14 (mol)
=> b = 36 (mol)
\(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{14}{50}.100\%=28\%\\\%V_{H_2}=\dfrac{36}{50}.100\%=72\%\end{matrix}\right.\)
Y chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\end{matrix}\right.\)
Z chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\\N_2O:6\left(mol\right)\end{matrix}\right.\)
\(Z\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{11}{11+27+6+6}.100\%=22\%\\\%V_{H_2}=\dfrac{27}{11+27+6+6}.100\%=54\%\\\%V_{NH_3}=\dfrac{6}{11+27+6+6}.100\%=12\%\\\%V_{N_2O}=\dfrac{6}{11+27+6+6}.100\%=12\%\end{matrix}\right.\)
b)
11,2 lít hh Z ở đktc chứa \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{11,2.22\%}{22,4}=0,11\left(mol\right)\\n_{H_2}=\dfrac{11,2.54\%}{22,4}=0,27\left(mol\right)\\n_{NH_3}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\\n_{N_2O}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\end{matrix}\right.\)
=> mZ = 0,11.28 + 0,27.2 + 0,06.17 + 0,06.44 = 7,28 (g)
Cho 5 lít khí N2 tác dụng với 5 lít khí H2 ở nhiệt độ cao, xúc tác thích hợp để tổng hợp khí NH3. Sau phản ứng thu được 7 lí hỗn hợp khí X gồm N2, H2, NH3. Tính thể tích mỗi khí trong hỗn hợp X thu được và hiệu suất phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện nhiệt độ và áp suất
N2 + 3H2 \(\overset{t^o,p,xt}{⇌}\) 2NH3.
Cứ 1 lít N2 tác dụng với 3 lít H2 tạo ra 2 lít NH3. Vậy a lít N2 tác dụng với 3a lít H2 tạo ra 2a lít NH3, thu được (5-a)+(5-3a)+2a=7 (lít), suy ra a=1,5 (lít).
Thể tích mỗi khí trong hỗn hợp X gồm khí N2 (5-1,5=3,5 (lít)), khí H2 (5-3.1,5=0,5 (lít)) và khí NH3 (2.1,5=3 (lít)).
Hiệu suất phản ứng là H=(5-0,5)/5.100%=90% (hiệu suất tính theo H2 do H2 thiếu).
Cho 17,92 lít hỗn hợp khí A (đktc) gồm 3 khí X, O2 và N2. Tỉ khối của A đối với H2 là 12,875. Số phân tử khí X gấp đôi số phân tử khí O2. % thể tích N2 trong hỗn hợp là 62,5%.
a/ Tìm CTHH của khí X.
b/ Tính % khối lượng từng khí trong hỗn hợp.
c/ Bơm thêm 0,4 gam khí hiđro vào hỗn hợp A thu được hỗn hợp khí B. Tính tỉ khối của B đối với
a)
\(V_{N_2}=\dfrac{17,92.62,5}{100}=11,2\left(l\right)\)
=> \(n_{N_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Gọi số mol O2 là a (mol)
=> nX = 2a (mol)
Có: \(2a+a+0,5=\dfrac{17,92}{22,4}=0,8\)
=> a = 0,1 (mol)
\(\overline{M}_A=\dfrac{0,1.32+0,2.M_X+0,5.28}{0,8}=12,875.2=25,75\left(g/mol\right)\)
=> MX = 17 (g/mol)
=> X là NH3
b) \(\left\{{}\begin{matrix}\%m_{N_2}=\dfrac{0,5.28}{0,5.28+0,2.17+0,1.32}.100\%=67,961\%\\\%m_{O_2}=\dfrac{0,1.32}{0,5.28+0,2.17+0,1.32}.100\%=15,54\%\\\%m_{NH_3}=\dfrac{0,2.17}{0,5.28+0,2.17+0,1.32}.100\%=16,505\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{0,4}{2}=0,2\left(mol\right)\)
\(\overline{M}_B=\dfrac{0,5.28+0,2.17+0,1.32+0,4}{0,5+0,2+0,1+0,2}=21\left(g/mol\right)\)
Tính tỉ khối của B với gì vậy bn :) ?
Cho 11,2 (l) hỗn hợp khí gồm N2 và NO, có tỉ khối của hỗn hợp khí so vs Hidro là 14,5. Tính khối lượng của hh khí.
$n_{khí} = \dfrac{11,2}{22,4} = 0,5(mol)$
$M_{khí} = 2M_{H_2} = 14,5.2 = 29(g/mol)$
$\Rightarrow m_{khí} = M.n = 29.0,5 = 14,5(gam)$
Cho hỗn hợp các khí N2, Cl2, HCl, CO2, O2 sục từ từ qua dung dịch NaOH dư thì hỗn hợp khí còn lại là:
A. N2, Cl2, O2.
B. Cl2, O2, HCl.
C. N2, Cl2, CO2, O2.
D. N2, O2.
N2, O2 không tác dụng với dung dịch NaOH
=>Chúng không bị dung dịch NaOH giữ lại. Các khí Cl2, HCl, CO2 bị dung dịch NaOH hấp thụ:
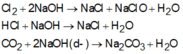
Đáp án D.
Một hỗn hợp A gồm hai khí N2 và H2 theo tỉ lệ 1:3. Tạo phản ứng giữa H2 với N2 cho ra NH3. Sau phản ứng thu được hỗn hợp khí B có tỉ khối: dA/B = 0,6. Tính hiệu suất phản ứng tổng hợp NH3.
A. 80%
B. 50%
C. 20%
D. 75%
Hỗn hợp sau nặng hay nhẹ hơn không khí?
a/Hỗn hợp khí N2 và CO.
b/Hỗn hợp đồng thể tích hai khí Cl2 và H2
a/ Hỗn hợp khí N2 và CO nặng hơn không khí. Khí CO có khối lượng riêng lớn hơn khí N2, do đó hỗn hợp này có khối lượng riêng lớn hơn không khí.
b/ Hỗn hợp đồng thể tích hai khí Cl2 và H2 nhẹ hơn không khí. Cả hai khí Cl2 và H2 đều có khối lượng riêng nhỏ hơn không khí, do đó hỗn hợp này có khối lượng riêng nhỏ hơn không khí.