Trong phân tử HClO4 chứa đồng vị O(z=8,A=16) ; H(z=1,A=1); Cl(z=17,A=35) Cl(z=17,A=37). Tính % về khối lượng của đồng vị Cl(z=17,A=37) trong HClO4 biết \(_{M_{Cl}}\)=35,5?
giúp e với ạ
Nguyên tử khối trung bình của Clo là 35,5. Clo trong tự nhiên có hai đồng vị là 35 Cl và 37 Cl. Tính phần trăm về khối lượng của 37 Cl chứa trong HClO4 (với Hidro đồng vị là 1 H, oxi đồng vị là 16 O)
\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=
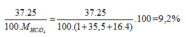
Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử clo. Tính thành phần % về khối lượng 37Cl có trong HClO4(H đồng vị 1, O đồng vị 16. Nguyên tử khối trung bình của Cl là 35,5
Đặt số mol HClO4 là 1 mol thì có 0,2423 mol 37Cl
\(\%m_{^{37}Cl}=\dfrac{37.0,2423}{1+35,5+16.4}.100\%\approx8,9205\%\)
trong tự nhiên, nguyên tố clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của Clo bằng 35,5. a) Tính phần trăm số nguyên tử của mỗi đồng vị trên?
b tính % khối lượng của cl35 có trong phân tử HCLO4 biết NTKtb của H+1 o=16,2
Trong tự nhiên clo có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl (Cl có số hiệu nguyên tử là 17).
Thành phần % theo khối lượng của 37Cl trong HClO4 là (Cho: H = 1, O = 16):
A. 8,92%
B. 8,43%
C. 8,56%
D. 8,79%
Đáp án A
• %35Cl = 100% - 24,23% = 75,77%
→ MCl = 37 x 0,2423 + 35 x 0,7577 = 35,4846.
→ Thành phần % của 37Cl trong HClO4 là
![]()
Trong tự nhiên clo là hỗn hợp 2 đồng vị 35Cl và 37Cl. Cho H = 1, O = 16, nguyên tử khối trung bình của clo là 35,5. Thành phần % về khối lượng 37Cl có trong HClO4 là
A. 9,20%.
B. 25,00%.
C. 35,32%.
D. 75,00%.
Đáp án A
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y.
Ta có hpt
x + y = 1 35 x + 37 y = 35 , 5
⇒ x = 0 , 75 y = 0 , 25
Phần trăm khối lượng của 37Cl trong HClO4 là
(0,24.37)/ (1+35,5+ 16.4) = 9,2 %
Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có 2 đồng vị là 35 Cl và 37Cl. Phần trăm khối lượng của 3717Cl chứa trong HClO4 ?(với hidro là đồng vị 11H, oxi là đồng vị 168O) là.
Tham thảo :
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
![]() , vậy x = 75%.
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4= 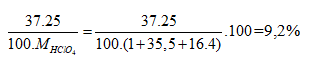
Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có hai đồng vị là C 35 l và C 37 l Thành phần phần trăm về khối lượng của C 17 35 l chứa trong H C l O 4 (với hiđro là đồng vị H 1 1 , oxi là đồng vị O 8 16 ) là
A. 9,40%
B. 8,95%
C. 9,67%
D. 9,20%
tính % khối lượng của đồng vị 35 Cl trong axit pecloric HCLO4 . Cho H=1;O=16
Oxi có ba đồng vị O(z=8,A=16) O(z=8,A=17) O(z=8,A=18); Cacbon có hai đồng vị: C(z=6,A=12); C(z=6,A=13).Có bao nhiêu phân tử khí Cacbonic tạo ra từ các đồng vị của hai nguyên tố trên?
Cacbonic :CO2
Từ 3 đvị của O ta viết đc
\(^{16}O^{16}O\); \(^{16}O^{17}O;^{16}O^{18}O;^{17}O^{18}O;^{17}O^{17}O;^{18}O^{18}O\)
Mà có 2 đvị C nên viết được 12 phân tử CO2 từ các đvị của 2 ntố trên