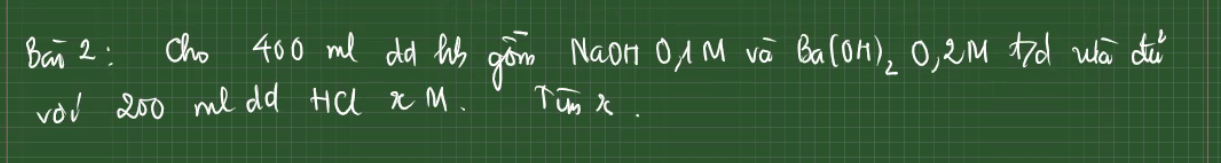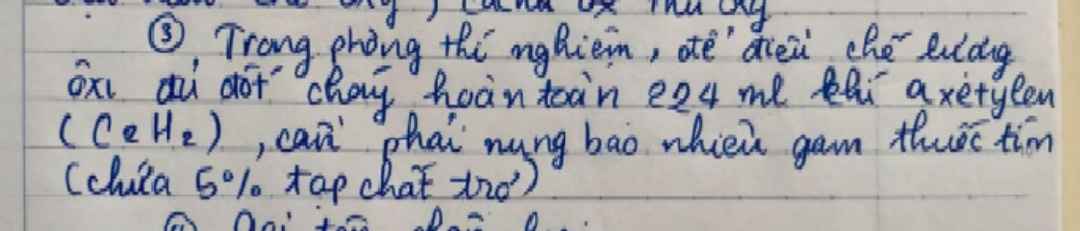Bài 33: Điều chế Hiđro - Phản ứng thế
Gọi số mol Al2O3, CuO là a, b (mol)
=> 102a + 80b = 18,2 (1)
nHCl = 2.0,4 = 0,8 (mol)
PTHH: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
a--->6a
CuO + 2HCl --> CuCl2 + H2O
b---->2b
=> 6a + 2b = 0,8 (2)
(1)(2) => a = 0,1; b = 0,1
=> \(\left\{{}\begin{matrix}\%m_{Al_2O_3}=\dfrac{102.0,1}{18,2}.100\%=56,044\%\\\%m_{CuO}=\dfrac{80.0,1}{18,2}.100\%=43,956\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Gọi số mol Al2O3, CuO là a, b (mol)
=> 102a + 80b = 18,2 (1)
nHCl = 2.0,4 = 0,8 (mol)
PTHH: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
a--->6a
CuO + 2HCl→ CuCl2 + H2O
b---->2b
Đúng 0
Bình luận (0)
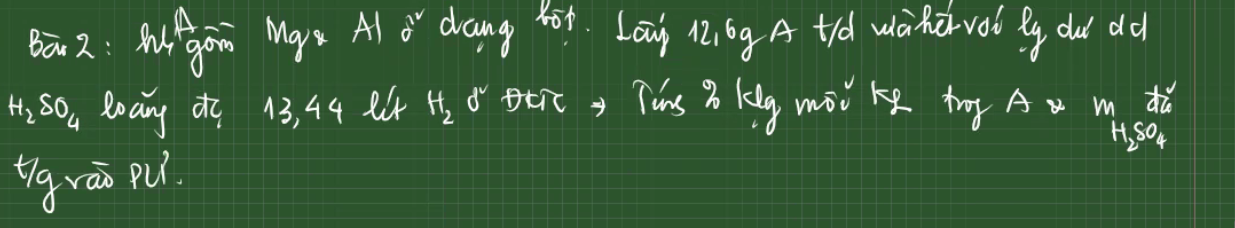
và phương pháp làm
Gọi nAl = a (mol); nMg = b (mol)
nH2 = 13,44/22,4 = 0,6 (mol)
27a + 24b = 12,6 (1)
PTHH:
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
Mol: a ---> 1,5a ---> 0,5a ---> 1,5a
Mg + H2SO4 -> MgSO4 + H2
Mol: b ---> b ---> b ---> b
1,5a + b = 0,6 (2)
Từ (1), (2) => a = 0,2 (mol); b = 0,3 (mol)
mAl = 0,2 . 27 = 5,4 (g)
%mAl = 5,4/12,6 = 42,85%
%mMg = 100% - 42,85% = 57,15%
Đúng 1
Bình luận (1)
Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 12,6 (1)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
a------>a------------------>a
2 Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b-------->1,5b----------------->1,5b
=> a + 1,5b = 0,6 (2)
(1)(2) => a = 0,3; b = 0,2
=> \(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,3.24}{12,6}.100\%=57,143\%\\\%m_{Al}=\dfrac{0,2.27}{12,6}.100\%=42,857\%\end{matrix}\right.\)
\(m_{H_2SO_4}=\left(a+1,5b\right).98=58,8\left(g\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH}=0,1.0,4=0,04\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,2.0,4=0,08\left(mol\right)\)
PTHH: NaOH + HCl --> NaCl + H2O
0,04---->0,04
Ba(OH)2 + 2HCl --> BaCl2 + 2H2O
0,08----->0,16
=> nHCl = 0,04 + 0,16 = 0,2 (mol)
=> \(xM=\dfrac{0,2}{0,2}=1M\)
Đúng 1
Bình luận (1)
Đổi 400 ml = 0,4 l
200 ml = 0,2 l
nNaOH = 0,1 . 0,4 = 0,04 (mol)
nBa(OH)2 = 0,2 . 0,4 = 0,08 (mol)
PTHH:
NaOH + HCl -> NaCl + H2O
Mol: 0,04 ---> 0,04
Ba(OH)2 + 2HCl -> BaCl2 + 2H2O
Mol: 0,08 ---> 0,16
nHCl = 0,16 + 0,04 = 0,2 (mol)
x = CMddHCl = 0,2/0,2 = 1M
Đúng 0
Bình luận (0)
Lấy cùng một khối lượng kẽm và nhôm cho vào dd H2SO4 loãng, dư. Kim loại nào cho nhiều khí hiđro hơn? Vì sao?
Giả sử mZn = mAl = a (g)
\(n_{Zn}=\dfrac{a}{65}\left(mol\right)\); \(n_{Al}=\dfrac{a}{27}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2 (1)
=> \(n_{H_2\left(1\right)}=\dfrac{a}{65}\left(mol\right)\)
2Al + 3H2SO4 -->Al2(SO4)3 + 3H2
=> \(n_{H_2\left(2\right)}=\dfrac{a}{18}\left(mol\right)\)
Có \(n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
=> Nhôm cho nhiều H2 hơn
Đúng 3
Bình luận (0)
giúp mik giải đúng nha đúng mik cho in4 nhưng chỉ 2k8 thôi nha😘😅😊mik con trai nha
3Fe+2O2-to>Fe3O4
0,3-----0,2---------0,1 mol
n Fe=\(\dfrac{16,8}{56}\)=0,3 mol
=>VO2=0,2.22,4=4,48l
=>m Fe3O4=0,1.232=23,2g
Đúng 6
Bình luận (2)
nFe = 16,8/56 = 0,3 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 ---> 0,2 ---> 0,1
VO2 = 0,2 . 22,4 = 4,48 (l)
mFe3O4 = 0,1 . 232 = 23,2 (g)
Đúng 0
Bình luận (0)
2KMnO4-to>K2MnO4+MnO2+O2
0,05-------------------------------------0,025
\(\dfrac{5}{2}\)O2+C2H2-to>2CO2+H2O
0,025---0,01
ta có :
n C2H2=\(\dfrac{0,224}{22,4}\)=0,01 mol
mà có 5% tạp chất
=>m KMnO4=0,05.158.\(\dfrac{105}{100}\)=8,295g
Đúng 1
Bình luận (1)
nC2H2 = 0,224/22,4 = 0,01 (mol)
PTHH:
2C2H2 + 5O2 -> (t°) 4CO2 + 2H2O
Mol: 0,01 ---> 0,025
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
Mol: 0,05 <--- 0,025 <--- 0,025 <--- 0,025
mKMnO4 = 0,05 . 158 = 7,9 (g)
m thuốc tím = 7,9 : (100% - 5%) = 158/19 (g)
Đúng 1
Bình luận (0)
Tính khối lượng Fe thu được khi cho 32g Fe2 O3 tác dụng với 3,36 khí H2 (đktc)
nFe2O3 = 32/160 = 0,2 (mol)
nH2 = 3,36/22,4 = 0,15 (mol)
PTH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,2 > 0,15/3 => Fe2O3 dư
nFe = 0,15 : 3 . 2 = 0,1 (mol)
mFe = 0,1 . 56 = 5,6 (g)
Đúng 1
Bình luận (0)
Cho 11,2 g bột sắt tác dụng với dd HCl vừa đủ, sau phản ứng ta thêm dd NaOH vào cho đến khi phản ứng kết thúc thì thu được 1 kết tủa
a, Viết PTHH xảy ra
b, Tính khối lượng kết tủa thu được
a , \(nFe=\dfrac{11,2}{56}=0,2\left(mol\right)\)
, pthh:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
1mol 2mol 1mol 1mol
0,2 0,4 0,2 0,2
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
1mol 2mol 1mol 2mol
0,2 0,4 0,2 0,4
b, \(mFe\left(OH\right)_2=0,2.90=18\left(gam\right)\)
Đúng 10
Bình luận (2)
Nhiệt phân hoàn toàn 24,5g potassium chlorate
a Viết PTHH và tính thể tích khí oxygen thu được ở đktc
b Đốt cháy 11,2g sắt bằng lượng khí oxygen thu được ở trên.Tính khối lượng sản phẩm
Giúp mik vs
a. \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH : 2KClO3 -to> 2KCl + 3O2
0,2 0,3
\(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
b.\(n_{O_2}=0,3\left(mol\right)\left[cmt\right]\)
\(m_{O_2}=0,3.32=9,6\left(g\right)\)
PTHH : 3Fe + 2O2 -to> Fe3O4
Theo ĐLBTKL
\(m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow11,2+9,6=20,8\left(g\right)\)
Đúng 2
Bình luận (3)
a: \(2KClO_3\rightarrow2KCl+3O_2\)
\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(\Leftrightarrow n_{O_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(lít\right)\)
b: \(4Fe+3O_2\rightarrow2Fe_2O_3\)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(\dfrac{n_{Fe}}{4}=\dfrac{0.2}{4}=0.05< \dfrac{n_{O_2}}{3}\) nên O2 dư
=>Tính theo Fe
\(n_{Fe_2O_3}=0.1\left(mol\right)\)
\(m_{Fe_2O_3}=0.1\cdot160=16\left(g\right)\)
Đúng 1
Bình luận (1)
Đốt cháy hoàn toàn hỗn hợp gồm CO và H2 cần phải dùng 3,36 lít khí oxi ở đktc và thu được 1,8g nước.
a) Tính thể tích mỗi chất trong hỗn hợp ban đầu
b) Tính khối lượng CO2 tạo thành
a)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,1<-0,05<-------0,1
2CO + O2 --to--> 2CO2
0,2<--0,1-------->0,2
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\V_{CO}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
b) \(m_{CO_2}=0,2.44=8,8\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\)
\(2CO+O_2\rightarrow2CO_2\)
a 0,5a a
\(2H_2+O_2\rightarrow2H_2O\)
0,1 0,05 \(\leftarrow\) 0,1
\(\Sigma n_{O_2}=0,5a+0,05=0,15\)
\(\Rightarrow a=n_{O_2\left(CO\right)}=0,2mol\)
\(V_{CO}=2\cdot0,2\cdot22,4=8,96l\)
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{CO_2}=0,2\cdot44=8,8g\)
Đúng 2
Bình luận (0)