Cho nhôm tác dụng với dung dịch HCL thu được ALCL3 và 3,36L khí H2 (đktc)
A,Tính Khối Lượng Nhôm Phản Ứng
B, Nếu có 5,Hg nhôm phản ứng thì thu được bao nhiêu lít H2
Giúp mk vs mk phải nộp gấp :((
Cho nhôm tác dụng với dung dịch HCL thu được ALCL3 và 3,36L khí H2 (đktc)
A,Tính Khối Lượng Nhôm Phản Ứng
B, Nếu có 5,Hg nhôm phản ứng thì thu được bao nhiêu lít H2
Giúp mk vs mk phải nộp gấp :((
Cho 26 gam Zn vào dung dịch HCl dư sau khi phản ứng xảy ra hoàn toàn thu được V lít H2 (đktc)
a, Tính V và khối lượng ZnCl2 thu được?
b, Dẫn V lít khí H2 trên qua ống nghiệm đựng 46,4 gam Fe2O3 nung nóng đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m và % theo khối lượng mỗi chất trong m?
c, Nếu dẫn khí H2 trên qua ống nghiệm đựng 46,4 gam chất rắn sau khi kết thúc phản ứng thu được 41,28 gam chất rắn. Tính hiệu suất phản ứng?
Câu c chất rắn là gì vậy bạn?
Cho 26 gam Zn vào dung dịch HCl dư sau khi phản ứng xảy ra hoàn toàn thu được V lít H2 (đktc)
a, Tính V và khối lượng ZnCl2 thu được?
b, Dẫn V lít khí H2 trên qua ống nghiệm đựng 46,4 gam nung nóng đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m và % theo khối lượng mỗi chất trong m?
c, Nếu dẫn khí H2 trên qua ống nghiệm đựng 46,4 gam chất rắn sau khi kết thúc phản ứng thu được 41,28 gam chất rắn. Tính hiệu suất phản ứng?
46,4 gam gì vậy bạn ( câu b ý )
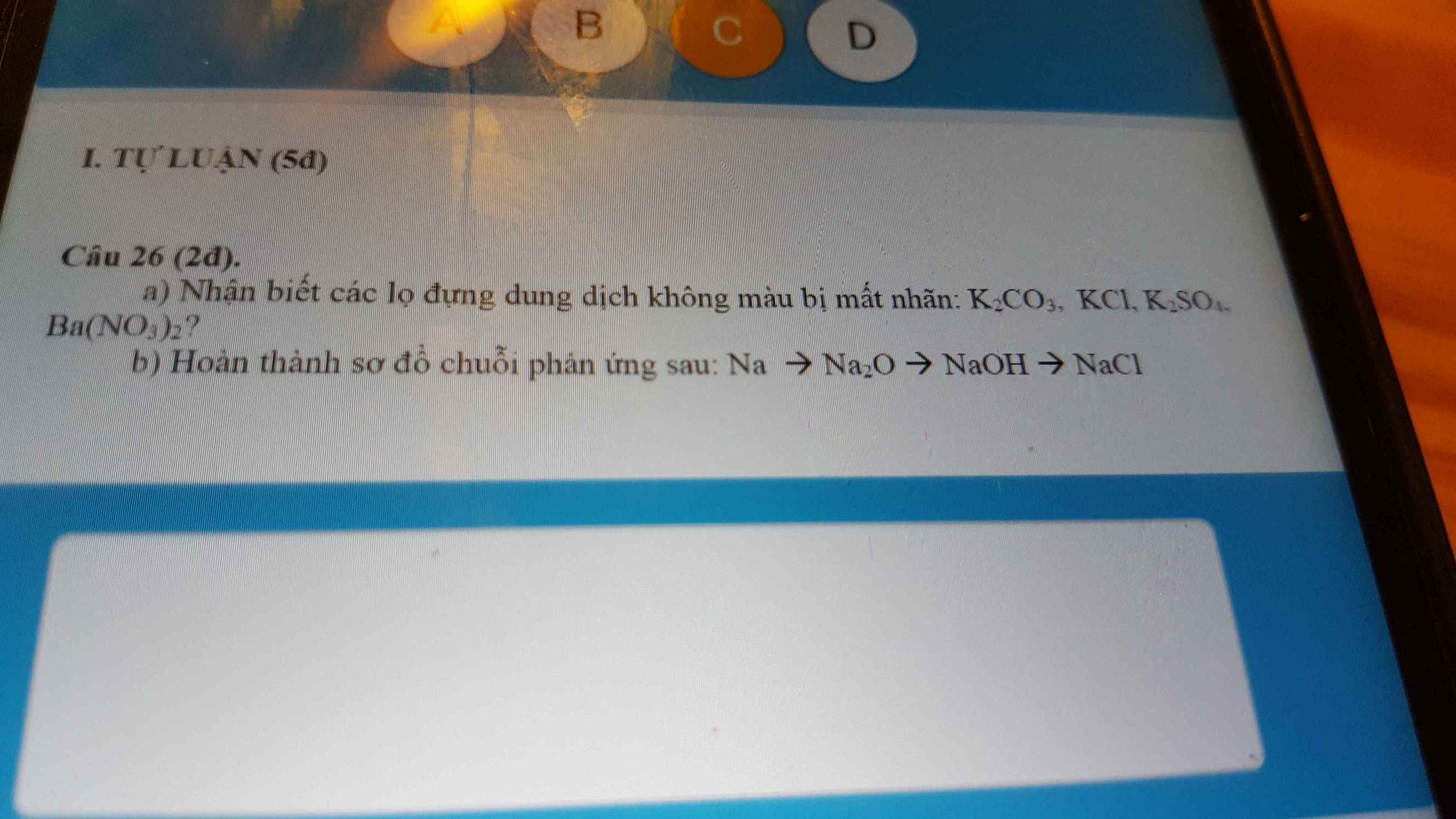
giúp mik c26
Cho 13 g kẽm vào bình chứa dung dịch axit clohidric.
a. Viết phương trình hóa học của phản ứng.
b. Tính thể tích khí hidro thu được (đktc).
c. Để có được lượng kẽm tham gia phản ứng trên, người ta phải dùng bao nhiêu gam kẽm oxit tác dụng với khí hidro (dư).
Help Mình Với ;-;
Cho 16,2 gam hỗn hợp A gồm Nhôm và Bạc vào dung dịch axit HCl (lấy dư), sau phản ứng thu được 6,72 lit khí H2 ( đktc)
a)Xác định thành phần khối lượng kim loại trong hỗn hợp A
b) Xác định khối lượng axit HCl đã lấy, biết axit đã lấy dư 20% so với lượng cần phản ứng ?
nH2 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,2 <--- 0,6 <--- 0,2 <--- 0,3
mAl = 0,2 . 27 = 5,4 (g)
mAg = 16,2 - 5,4 = 10,8 (g)
mHCl (p/ư) = 0,6 . 36,5 = 21,9 (g)
mHCl (ban đầu) = 21,9/(100% - 20%) = 27,375 (g)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,9 0,3
\(m_{Al}=0,2\cdot27=5,4g\)\(\Rightarrow m_{Ag}=16,2-5,4=10,8g\)
a)\(\%m_{Al}=\dfrac{5,4}{16,2}\cdot100\%=33,33\%\)
\(\%m_{Mg}=100\%-33,33\%=66,67\%\)
b)\(\Sigma n_{HCl}=0,9mol\Rightarrow m_{HCl}=32,85g\)
Lượng axit đã lấy:
\(m_{ddHCl}=\dfrac{32,85}{20\%}\cdot100\%=164,25g\)
Bài 1.
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(n_{Fe_2O_3}=\dfrac{24}{160}=0,15mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,15 0,3
0,1 0,3 0,2 0,3
0,05 0 0,2 0,3
\(m_{Fe}=0,2\cdot56=11,2g\)
\(m_{Fe_2O_3dư}=0,05\cdot160=8g\)
Bài 2.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\)
0,1 0,3 0,4
\(m_{Fe_3O_4}=0,1\cdot232=23,2g\)
\(V_{CO_2}=0,4\cdot22,4=8,96l\)
1.
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{24}{160}=0,15mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,15 > 0,3 ( mol )
0,1 0,3 0,2 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,2.56=11,2g\)
\(m_{Fe_2O_3\left(du\right)}=n.M=\left(0,15-0,1\right).160=8g\)
2.
\(n_{Fe}=\dfrac{m}{M}=\dfrac{16,8}{56}=0,3mol\)
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\)
0,1 0,3 0,4 ( mol )
\(m_{Fe_3O_4}=n.M=0,1.232=23,2g\)
\(V_{CO_2}=n.22,4=0,4.22,4=8,96l\)
nFe = 16,8/56 = 0,3 (mol)
PTHH: Fe3O4 + 4CO -> (t°) 3Fe + 4CO2
Mol: 0,1 <--- 0,4 <--- 0,3 <--- 0,4
VCO2 = 0,4 . 22,4 = 8,96 (l)
mFe3O4 = 0,1 . 232 = 23,2 (g)
nZnO = 20,25/81 = 0,25 (mol)
PTHH: ZnO + H2 -> (t°) Zn + H2O
Mol: 0,25 ---> 0,25
VH2 = 0,25 . 22,4 = 5,6 (l)
cho 13 g zn vào dd axit hcl toàn bộ khí sinh ra cho đi qua fe2o3 nung nống .tính khối lượng fe sinh ra
Zn + 2HCl -> ZnCl2 + H2
nZn = 13/65 = 0,2 ( mol )
=> nH2 = nZn = 0,2 ( mol )
Fe2O3+3H2→2Fe+3H2O
-> nFe = 2/3nH2 = 2/15 ( mol )
=> m = 2/15 . 56 = 7,46 (g)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,2 0,2
Mà H2 là chất khí
PTHH : Fe2O3 + 3H2 ---to---> 2Fe + 3H2O
0,2 \(\dfrac{0.4}{3}\)
\(m_{Fe}=\dfrac{0.4}{3}.56=\dfrac{22,4}{3}\left(g\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1<--0,2<-------0,1<--0,1
=> mZn = 0,1.65 = 6,5 (g)
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{8,5}.100\%=76,47\%\\\%m_{MgO}=\dfrac{8,5-6,5}{8,5}.100\%=23,53\%\end{matrix}\right.\)
\(n_{MgO}=\dfrac{8,5-6,5}{40}=0,05\left(mol\right)\)
PTHH: MgO + 2HCl --> MgCl2 + H2O
0,05->0,1-------->0,05
=> nHCl = 0,2 + 0,1 = 0,3 (mol)
=> \(aM=C_M=\dfrac{0,3}{0,2}=1,5M\)
A chứa \(\left\{{}\begin{matrix}ZnCl_2:0,1\left(mol\right)\\MgCl_2:0,05\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(ZnCl_2\right)}=\dfrac{0,1}{0,2}=0,5M\\C_{M\left(MgCl_2\right)}=\dfrac{0,05}{0,2}=0,25M\end{matrix}\right.\)