Giúp emm với ạ em cần gấp
Bài 29: Bài luyện tập 5
CaO+H2O->Ca(OH)2 canxi hidroxit (hóa hợp)
2K+2H2O->2KOH+H2 kali hidroxit (thế)
SO3+H2O->H2SO4 axit sunfuric (hóa hợp)
Đúng 6
Bình luận (0)
 mng giúp em với em cần gấpp 😢
mng giúp em với em cần gấpp 😢
| CTHH | Phân loại | Gọi tên |
| Fe2O3 | Oxit bazơ | Sắt (III) oxit |
| HCl | Axit | Axit clohiđric |
| H2SO4 | Axit | Axit sunfuric |
| NaOH | Bazơ | Natri hiđroxit |
| MgCl2 | Muối | Magie clorua |
| Al2O3 | Oxit lưỡng tính | Nhôm oxit |
| CO2 | Oxit axit | cacbon đioxit |
| P2O5 | Oxit axit | điphotpho pentaoxit |
| Cu(NO3)2 | Muối | Đồng (II) nitrat |
| Na2O | Oxit bazơ | Natri oxit |
| FeO | Oxit bazơ | Sắt (II) oxit |
| N2O | Oxit trung tính | đinitơ oxit |
| Zn(OH)2 | Bazơ | Kẽm hiđroxit |
| KHCO3 | Muối | Kali hiđrocacbonat |
| Fe(OH)2 | Bazơ | Sắt (II) hiđroxit |
| CaSO4 | Muối | Canxi sunfat |
| Ca(H2PO4)2 | Muối | Canxi đihiđrophotphat |
| H3PO4 | Axit | Axit photphoric |
Đúng 4
Bình luận (0)
đọc tên CTHH sau: Fe(NO3)3, Na2SO4, Al2(SO4)3
Fe(NO3)3 đọc là : Sắt(III) Nitrat
Na2SO4 đọc là:Natri Sunfat
Al2(SO4)3 đọc là : Nhôm sunfat.
Đúng 2
Bình luận (0)
=> sắt; Nitrat
=> Natri Sunfat
=> Nhôm Sunfat
Đúng 0
Bình luận (0)
đọc tên công thức hóa học sau ZnCl2
Tham Khảo:
Kẽm chloride là tên của các hợp chất với công thức hóa học ZnCl2 và các dạng ngậm nước của nó. Kẽm chloride, với tối đa ngậm 9 phân tử nước, là chất rắn không màu hoặc màu trắng, hòa tan rất mạnh trong nước. ZnCl2 khá hút ẩm và thậm chí dễ chảy nước.
Đúng 4
Bình luận (4)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 12,8g đồng trong oxi thu được Đồng(ll) oxit a, Tính thể tích khí oxi cần dùng đktc? b,tính khối lượng Đồng (ll) oxit tạo thành
\(n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
Pt : \(2Cu+O_2\underrightarrow{t^o}2CuO|\)
2 1 2
0,2 0,1 0,2
a) \(n_{O2}=\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
\(V_{O2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
b) \(n_{CuO}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{CuO}=0,2.80=16\left(g\right)\)
Chúc bạn học tốt
Đúng 4
Bình luận (0)
a.\(n_{Cu}=\dfrac{m}{M}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
PTHH: \(2Cu+O_2\rightarrow^{t^0}2CuO\)
2 : 1 : 2
0,2 : 0,1 : 0,2
\(\Rightarrow V_{O_2\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\).
b. \(m_{CuO}=n.M=0,2.80=16\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 1 que đóm còn tàn đỏ vào một lọ thủy tinh chứa khí oxygen. Em hãy dự đoán hiện tượng sẽ sảy ra. Thí nghiệm này cho thấy vai trò của khí oxgyen
Đúng 0
Bình luận (0)
đốt cháy hoàn toàn 5,6g nhôm thu được nhôm oxit
a) tính Vo2( ở điều kiện tiêu chuẩn)
b) tính khối lượng sản phẩm thu được
4Al+3O2-to>2Al2O3
\(\dfrac{28}{135}\)--\(\dfrac{7}{45}\)------\(\dfrac{14}{135}\)
n Al=\(\dfrac{5,6}{27}\)=\(\dfrac{28}{135}\)mol
=>VO2=\(\dfrac{7}{45}\).22,4=3,484l
=>m Al2O3=\(\dfrac{14}{135}\).102=10,578g
Đúng 4
Bình luận (0)
\(V=1344m^3=1,344l\)
a)\(V_{O_2}=1344\cdot10\%=134,4cm^3\)
b)\(n_{O_2bđ}=\dfrac{1,344}{22,4}=0,06mol\)
\(\Rightarrow m_{O_2}=0,06\cdot32=1,92g\)
\(BTKL:m_{KClO_3}=m_{CRắn}+m_{O_2}\)
\(\Rightarrow m_{CRắn}=12-1,92=10,08g\)
\(\%m_{CRắn}=\dfrac{10,08}{12}\cdot100\%=84\%\)
Đúng 4
Bình luận (0)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,24}{22,4}=0,1mol\)
\(n_{CH_4}=\dfrac{m_{CH_4}}{M_{CH_4}}=\dfrac{2,4}{16}=0,15mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
1 2 1 2 ( mol )
0,15 > 0,1 ( mol )
0,05 0,1 0,05 0,2 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,2.18=3,6g\)
\(V_{CO_2}=n_{Co_2}.22,4=0,05.22,4=1,12l\)
Chất dư là \(CH_4\)
\(n_{CH_4\left(du\right)}=0,15-0,05=0,1mol\)
\(m_{CH_4\left(du\right)}=n_{CH_4\left(du\right)}.M_{CH_4}=0,1.16=1,6g\)
\(\%CH_4\left(du\right)=\dfrac{1,6.100}{2,4}\simeq66,67\%\)
Đúng 2
Bình luận (0)
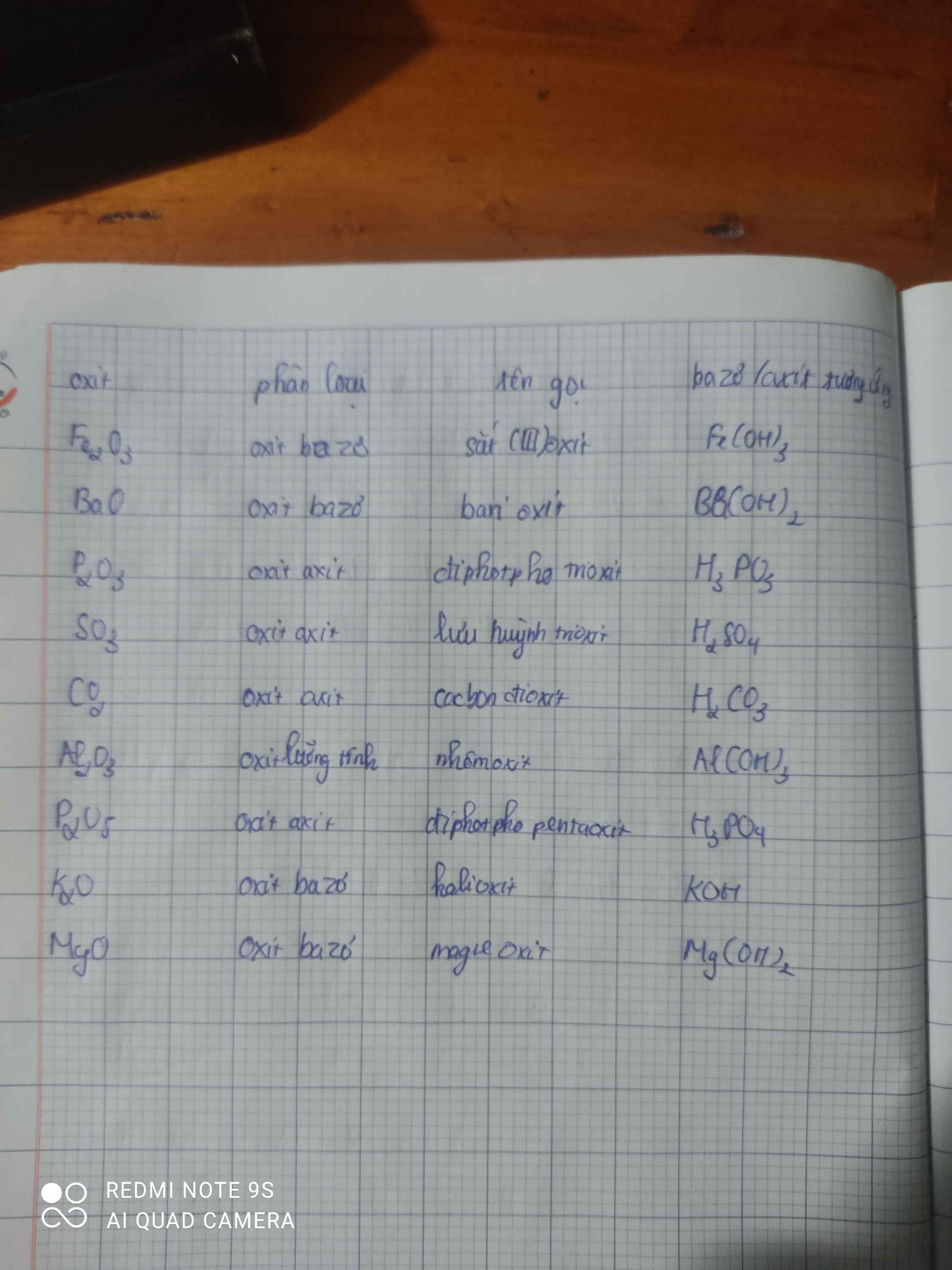
| Tên oxit bazo | Gọi tên | Hợp chất bazo t/ư |
| \(Fe_2O_3\) | Sắt (lll) oxit | \(Fe\left(OH\right)_3\) |
| \(BaO\) | Bari oxit | \(Ba\left(OH\right)_2\) |
| \(CuO\) | Đồng (ll) oxit | \(Cu\left(OH\right)_2\) |
| \(Al_2O_3\) | Nhôm oxit | \(Al\left(OH\right)_3\) |
| \(K_2O\) | Kali oxit | \(KOH\) |
| \(MgO\) | Magie oxit | \(Mg\left(OH\right)_2\) |
Làm tương tự với các chất oxit axit sau \(SO_3;CO_2;P_2O_5\)
Đúng 2
Bình luận (0)