Hãy tìm cách làm mất màu dung dịch brom mà KHÔNG ĐƯỢC dùng bất cứ chất khí nào.
Bài 25: Flo - Brom - Iot
Cho dung dịch $C_5H_{10}$ vào dung dịch Brom.
Hiện tượng : màu nâu đỏ của dung dịch brom nhạt màu dần rồi mất màu.
$C_{5}H_{10} + Br_2 \to C_5H_{10}Br_2$
Đúng 1
Bình luận (0)
So sánh các chất Flo - brom - iot.
Em cảm ơn trước ạ
Tham khảo:
Giống nhau:
Tính oxi hóa mạnh, tính oxi hóa sắp xếp theo chiều tăng dần: Iot < Brom < Clo < Flo.
Thể hiện qua các phản ứng:
+ Tác dụng với kim loại: X2+2Na→2NaX
+ Tác dụng với H2H2: X2+H2→2HX
Khác nhau:
- Khả năng phản ứng với các chất Flo phản ứng mãnh liệt, clo, brom, iot phản ứng với mức độ giảm dần.
- Flo chỉ có tính oxi hóa, trong khi đó clo, brom, iot có cả tính khử.
- Khi phản ứng với nước:
+ Flo phản ứng mãnh liệt, chỉ thể hiện tính oxi hóa:
2F2+2H2O→4HF+O2
+ Clo, brom phản ứng, thể hiện tính oxi hóa - khử:
Cl2+H2O→HCl+HClOBr2+H2O→HBr+HBrO
+ Iot gần như không phản ứng với nước.
- Khi phản ứng với sắt:
+ Flo, clo, brom đều tạo hợp chất sắt (III):
3Cl2+2Fe→2FeCl3
+ Iot chỉ tạo được hợp chất sắt (II):
I2+Fe→FeI2
Đúng 0
Bình luận (1)
Câu 2 câu 3 ai giúp với
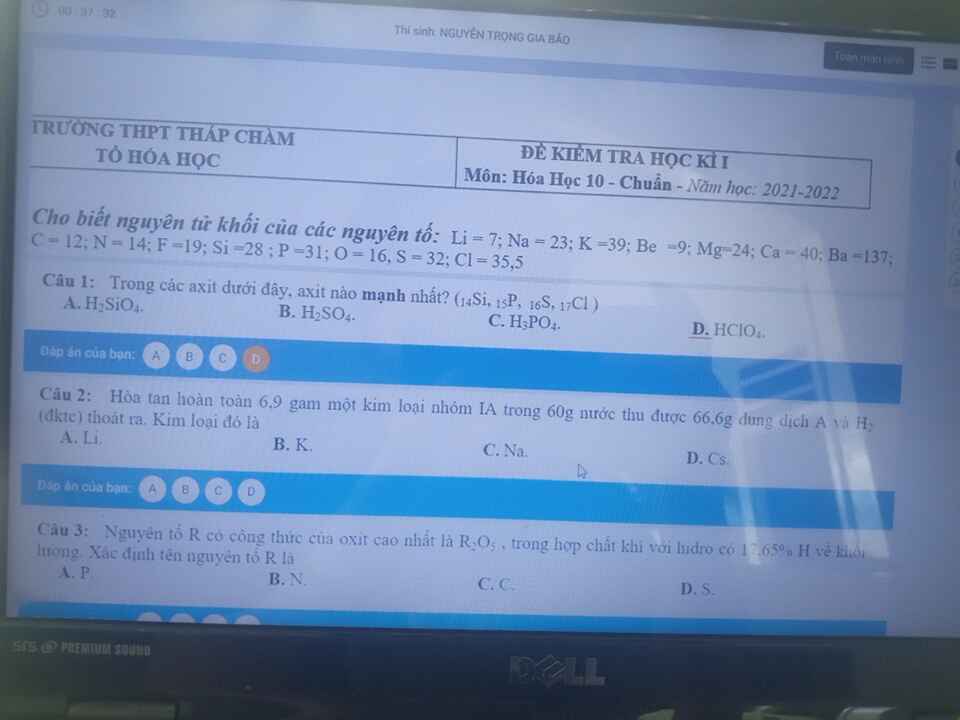
Tính chất hóa học đặc trưng của brom là gì? So sánh tính này với F2, Cl2
brom là một phi kim điển hình ở nhóm halogen, có 7e lớp ngoài cùng trong cấu hình electron
Tính phi kim: \(F_2>Cl_2>Br_2\)
Đúng 1
Bình luận (0)
Giúp mình giải viết phương trình chứng tỏ flo> clo
\(H_2+F_2\rightarrow2HF\)
=> Phản ứng ngay ở nhiệt độ rất thấp – 2520C
\(H_2+Cl_2\rightarrow2HCl\)
=> Phản ứng xảy ra khi chiếu sáng.
Đúng 1
Bình luận (0)
Câu 1: cho 2,24 lít khí clo phản ứng với Na. Tính khối lượng muối thu được( Na=23, Cl=35,5)
Câu 2: Hòa tan hoàn toàn 1,45g hỗn hợp 3 kim loại Zn,Mg, Fe bằng dung dịch HCl dư thấy thoát ra 0,896 lít khí (đktc). Tính khối lượng muối khan thu được sau phản ứng.
Câu 1:
PTHH: \(Na+\dfrac{1}{2}Cl_2\xrightarrow[]{t^o}NaCl\)
Ta có: \(n_{NaCl}=2n_{Cl_2}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 2:
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\) \(\Rightarrow m_{H_2}=0,04\cdot2=0,08\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\) \(\Rightarrow m_{HCl}=0,08\cdot36,5=2,92\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=4,29\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 2 :
nH2 = 0.896 / 22.4 = 0.04 (mol)
nHCl = 2nH2 = 0.04 * 2 = 0.08 (mol)
mHCl = 0.08 * 36.5 =2.92 (g)
BTKL :
mM = mKl + mHCl - mH2 = 1.45 + 2.92 - 0.04*2 = 4.29 (g)
Đúng 2
Bình luận (0)
cho a gam dung dịch HCl C% tác dụng với một lượng hỗn hợp 2 kim loại Na dư và K dư thấy khối lượng H2 bay ra là 0,05 a gam. tìm C phần trăm
cho một lượng dung dịch AgNO3 dư tác dụng với 100 ml dung dịch hỗn hợp NaF 0,02 M và NaCl 0,2 M. khối lượng kết tủa thu được là
NaF không phản ứng với dung dịch bạc nitrat.
\(NaCl + AgNO_3 \to AgCl + NaNO_3\\ n_{AgCl} = n_{NaCl} = 0,1.0,2=0,02(mol)\\ m_{AgCl} = 0,02.143,5=2,87(gam)\)
Đúng 2
Bình luận (0)
viết PTHH của các phản ứng trong sơ đồ chuyển hóa sau:
MnO2 -> Cl2 -> HCl -> Nacl -> Cl2 -> Naclo
\(MnO_2 + 4HCl \xrightarrow{t^o} MnCl_2 + Cl_2 + 2H_2O\\ Cl_2 + H_2 \xrightarrow{as} 2HCl\\ NaOH + HCl \to NaCl + H_2O\\ 2NaCl \xrightarrow{đpnc} 2Na + Cl_2\\ 2NaOH + Cl_2 \to NaCl + NaClO + H_2O\)
Đúng 3
Bình luận (0)





