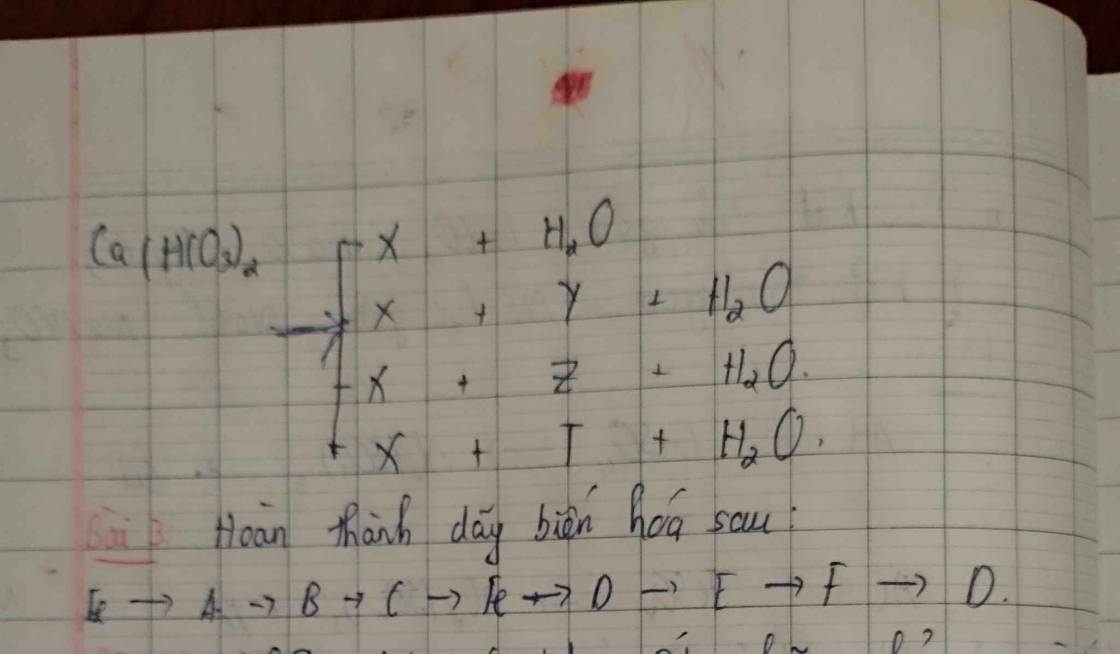Bài 1
\(\left(1\right)CuSO_4+BaCl_2\rightarrow CuCl_2+BaSO_4\)
\(\left(2\right)CuCl_2-^{đpdd}\rightarrow Cu+Cl_2\)
\(\left(3\right)Cu+Fe_2\left(SO_4\right)_3\rightarrow2FeSO_4+CuSO_4\)
\(\left(4\right)3CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
\(\left(5\right)Al_2\left(SO_4\right)_3+3Ba\left(NO_3\right)_2\rightarrow2Al\left(NO_3\right)_3+3BaSO_4\)
\(\left(6\right)Al\left(NO_3\right)_3+3KOH\rightarrow Al\left(OH\right)_3+3KNO_3\)
Bài 2: Cho dung dịch HCl vào các mẫu thử
+ Không tan : Cu, Ag (Nhóm I)
+ Tan, có khí thoát ra : Fe, Mg (Nhóm II)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
Xét nhóm (II)
Dùng dung dịch NaOH cho vào dung dịch sau phản ứng của kim loại khi bị HCl hòa tan
+ Kết tủa trắng xanh => Dung dịch là FeCl2 và kim loại ban đầu là Fe
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
+ Kết tủa trắng => Dung dịch là MgCl2 và kim loại ban đầu là Mg
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
Xét nhóm (I)
Cho dung dịch AgNO3 vào 2 kim loại Cu và Ag
+ Có kim loại màu xác bám ngoài kim loại ban đầu. Dung dịch ban đầu không màu chuyển dần sang màu xanh.Kim loại đã đẩy bạc ra khỏi dung dịch Bạc Nitrat và một phần kim loại bị hoà tan tạo ra dung dịch màu xanh lam => Kim loại đó là Cu
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
+ Còn lại kim loại không hiện tượng là Ag