Khử hoàn toàn m(g) hỗn hợp A gồm Fe2O3,Fe3O4,FeO bằng co cần dùng 8,96 lít CO ở đktc thu được 0,3 mol Fe.
Cho hh A tác dụng với HNO3 dư thu được V (lít) khí NO2 (đktc).
XÁC ĐỊNH m và V
Khử hoàn toàn m(g) hỗn hợp A gồm Fe2O3,Fe3O4,FeO bằng co cần dùng 8,96 lít CO ở đktc thu được 0,3 mol Fe.
Cho hh A tác dụng với HNO3 dư thu được V (lít) khí NO2 (đktc).
XÁC ĐỊNH m và V
Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và,người ta thu được 1,68 lít khí hiđro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng mạt sắt đã phản ứng.
c) tính khối lượng axit sunfuric còn dư trong dung dịch sau phản ứng
a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,075\left(mol\right)\Rightarrow m_{Fe}=0,075.56=4,2\left(g\right)\)
c, \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,075\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,075=0,125\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,125.98=12,25\left(g\right)\)
X 1 Có 0,75 mol một oxit sắt chứa 22.5 * 10 ^ 23 nguyên tử sắt và oxi. Tìm công thức hóa học của oxit sắt.
CTTQ:FexOy
ta có: 0,75x+0,75y=3,75
=>y=(3,75-0,75x)/0,75
x có giá trị 1 2 3
=>x=2 =>y=3
=>CTHH:Fe2O3
Người ta dùng 13,44l khí Hidro (ở đktc) để khử 40g sắt (III) oxit (FE2O3) ở nhiệt độ thích hợp. kết thúc phản ứng người ta thu được a gam chất rắn
a) Viết PTPƯ xảy ra
b) Tính khối lượng nước tạo thành
c) Tính a
giúp tớ với mai tớ thi rùiii
`H_2=13,44/(22,4)=0,6`mol
`m_(Fe_2O_3)=40/160=0,25`mol
a)`3H_2+Fe_2O_3->2Fe+3H_2O`(nhiệt độ )
`0,6--0,2--0,4--0,6`mol
`Lập tỉ lệ : ((0,6)/3)<0,25`
`Vậy (Fe_2O_3) còn dư`
b)`m_(H_2O)=0,6.18=10,8g`
c)`m_(chất rắn)=0,4.56+0,05.160=30,4g`
a) \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right);n_{Fe_2O_3}=\dfrac{40}{160}=0,25\left(mol\right)\)
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,25}{1}>\dfrac{0,6}{3}\Rightarrow\) Fe2O3 dư
0,2<-----0,6----->0,4--->0,6
b) `m_{H_2O} = 0,6.18 = 10,8 (g)`
c) `a = 0,4.56 + (0,25 - 0,2).160 = 30,4 (g)`
Cho (6) g một đinh sắt vào 200ml dd CuSO4 2M, sau một thời gian lấy đinh sắt ra thấy khối lượng của đinh sắt là 6,12g. Tính mCu bám vào đinh sắt và CM các chất trong đ sau PƯ
a. dung dịch h2so4 10% có chứa 15g h2so4
b, dung dịch NaHCO3 25% có chứa 34g NaHCO3
a)\(m_{H_2SO_4}=\dfrac{m_{ddH_2SO_4}\cdot C\%}{100\%}=\dfrac{15\cdot10\%}{100\%}=1,5g\)
b)\(m_{NaHCO_3}=\dfrac{m_{ddNaHCO_3}\cdot C\%}{100\%}=\dfrac{34\cdot25\%}{100\%}=8,5G\)
vẽ sơ đồ tư duy tóm tắt kiến thức lớp 8 về dung dịch
Cho 150g dun dịch H2SO4 20% tác dụng với 6,5g kẽm kim loại. Tính nồng độ phần trăm của dung dịch thu được sau phản ứng
nzn=6,5:65=0,1 (mol)
mh2so4=150.20%:100%=30 g
nh2so4=30:36,5=0,821(mol)
pt:H2SO4+zn =>ZnSO4 +H2
theo pt:0,1; 0,1; 0,1; 0,1
vì 0,1<0,821 nên n h2so4 dư:0,821-0,1=0,721 (mol)
tính theo số mol zn
mH2=0,1.2=0,2 g
mZnSO4=0,1.161=16,1 g
mH2SO4 dư=0,721.98=70,658 g
mdd thu đc=150+6,5-0,2=156,3 g
C%H2SO4 dư=70,658:156,3.100%=45,206%
C%ZnSO4=16,1:156,3.100%=10,300%.
Bạn tham khảo nhé
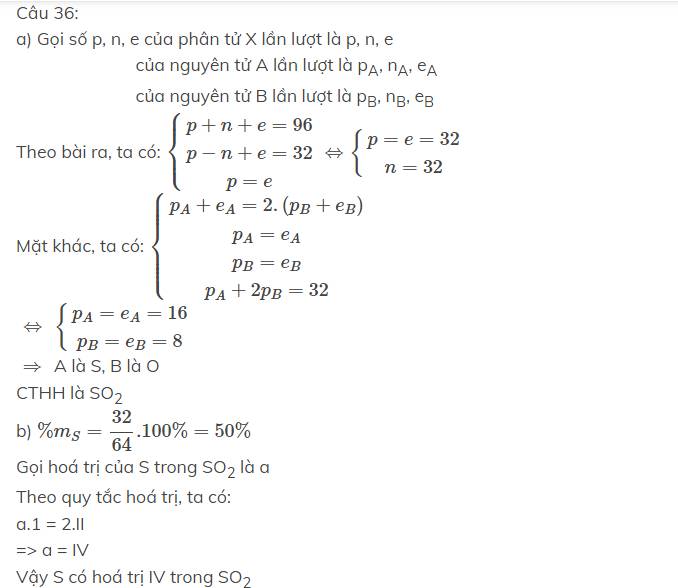
Bổ sung thêm phần a là số khối của S là 32, của O là 16
Chi tiết hơn tại: https://hoc24.vn/cau-hoi/.6765277239454
Hòa tan hoàn toàn 1,44g kim loại R(II) bằng 200ml dd H2SO4 0,3M Để trung hòa hoàn toàn axit dư cần 60ml dd NaOH 0,5M. Tìm R
$n_{H_2SO_4} = 0,2.0,3 = 0,06(mol)$
$n_{NaOH} = 0,06.0,5 = 0,03(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,015(mol)$
$n_{H_2SO_4\ pư} = 0,06 - 0,015 = 0,045(mol)$
$R + H_2SO_4 \to RSO_4 + H_2$
$n_R = n_{H_2SO_4} = 0,045(mol)$
$\Rightarrow R = \dfrac{1,44}{0,045} = 32$
(Sai đề)