Nguyên tử Y có 3 lớp electron và có 7 electron lớp ngoài cùng
a. Vẽ mô hình nguyên tử Y
b. Xác định số proton, neutron, electron của Y. Biết số neutron nhiều hơn số proton là 1.
Nguyên tử Y có 3 lớp electron và có 7 electron lớp ngoài cùng
a. Vẽ mô hình nguyên tử Y
b. Xác định số proton, neutron, electron của Y. Biết số neutron nhiều hơn số proton là 1.
a) Sơ đồ nguyên tử Y là:
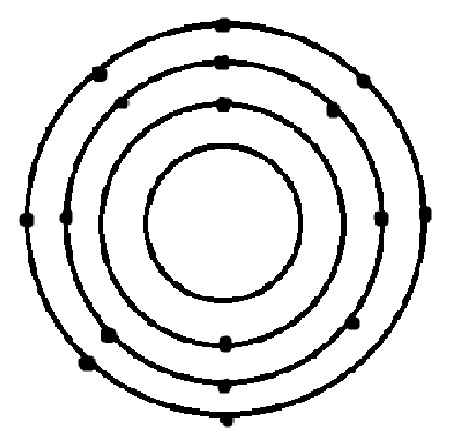
b)Vì nguyên tử Y có 3 lớp electron
Ta đã được biết: Lớp electron thứ nhất của mỗi nguyên tử sẽ có tối đa 2 electron
Lớp electron thứ hai của mỗi nguyên tử sẽ có tối đa 8 electron
Nên nguyên tử Y có số electron là:2+8+7=17(hạt)
Vì số electron và proton của mỗi nguyên tử đều bằng nhau
nên số proton =số electron = 17 (hạt)
Theo đề bài ta có:Số hạt neutron hơn số hạt electron là 1 hạt
nên số hạt neutron= số hạt proton + 1 =17+1=18 (hạt)
Cho 2,7 gam kim loại M thuộc IIIA tác dụng hết với 250ml dd HCl 2M sau phản ứng thu được dd X và 0,15 mol h2 .cho dd X tác dụng với 200ml dd naoh 1,75 sau phản ứng thu được m gam kết tủa.xác định kim loại và tính m?
Nguyên tố R thuộc nhóm VIA trong bảng tuần hoàn trong công thức oxide cao nhất có tỉ lệ khối lượng của O số với R là 1,5 .xác định nguyên tố R
Nguyên tố R thuộc nhóm VIA => Công thức oxide cao nhất có dạng : RO3
\(\dfrac{M_O}{M_R}=1.5\Rightarrow\dfrac{16\cdot3}{M_R}=1.5\Rightarrow M_R=32\)
R là S ( Lưu huỳnh )
Trong tự nhiên chlorine có 2 đồng vị bền : ³⁷Cl chiếm 24,23% tổng số nguyên tử ,còn lại là ³⁵Cl . Thành phần % theo khối lượng của ³⁵Cl trong HClO4
Mọi người giúp em với ạ. Trong tự nhiên Copper có 2 đồng vị bền:63/29Cu chiếm 75% số nguyên tử và 65/29Cu chiếm 25% số nguyên tử. a) Tính nguyên tử khối trung bình của Copper. b) Tính % khối lượng đồng vị 65/29Cu có trong 1 mol CuSO4? Cho NTK của S=32 ; O=16.
Cho tổng các hạt p,n,e trong nguyên tử nguyên tố X là 58. Biết số hạt trong nhân nhiều hơn số hạt ở vỏ là 20 hạt a) Viết kí hiệu nguyên tử của nguyên tố X và đọc tên b) Cho 7,8g X vào 100g H2O dư được dung dịch A và V lít khí H2 (25 độ C ,1 bar) Tính V và C% của dung dịch A
\(a)\left\{{}\begin{matrix}n+p+e=58\\p=e\\p+n=20+e\end{matrix}\right.\\ \Rightarrow p=e=19;n=20\\ \Rightarrow X:Kali\\ b)n_K=\dfrac{7,8}{39}=0,2mol\\ 2K+2H_2O\rightarrow2KOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2\left(đkc\right)}=0,1.24,79=2,479l\\ C_{\%KOH}=\dfrac{0,2.56}{7,8+100}\cdot100\%\approx10,39\%\)
. Hợp chất X2Y6 có tổng số các loại hạt là 392, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 120 hạt. Số khối của X ít hơn số khối của Y là 8. Tổng số hạt trong X3+ nhiều hơn của Y- là 13.
a) Xác định X, Y.
Có: P = E (Do nguyên tử trung hòa về điện.)
- Tổng số hạt trong X2Y6 là 392
⇒ 2.(2PX + NX) + 6.(2PY + NY) = 392 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 120 hạt.
⇒ 2.2PX + 6.2PY - 2NX - 6NY = 120 (2)
- Số khối của X ít hơn số khối của Y là 8.
⇒ PY + NY - (PX + NX) = 8 (3)
- Tổng số hạt trong X3+ ít hơn Y- là 16.
⇒ (2PY + NY + 1) - (2PX + NX - 3) = 16 (4)
Từ (1), (2), (3) và (4) \(\Rightarrow\left\{{}\begin{matrix}P_X=E_X=13\\N_X=14\\P_Y=E_Y=17\\N_Y=18\end{matrix}\right.\)
⇒ X là Al, Y là Cl.
2(2p + n) + 2(2p’ + n’) = 164
(4p + 4p’) - 2(n + n’) = 52
(p + n) - (p’ + n’) = 23
(2p + n - 1) - 2(2p’ + n’) + 2 = 7
Tìm p,n,p',n'
Đã có 4 PT như trên rồi thì bạn chỉ cần bấm máy tính để giải hệ PT 4 ẩn thôi nhé.
\(\left\{{}\begin{matrix}p=19\\n=20\\p'=8\\n'=8\end{matrix}\right.\)
Tổng số hạt mang điện trong phân tử XYO4 là 136.Số hạt mang điện trong nguyên tử Y ít hơn ngyên tử X là 4.Xác định số hiệu nguyên tử X,Y
Có: P = E (Do nguyên tử trung hòa về điện.)
- Tổng số hạt mang điện trong XYO4 là 136.
⇒ 2PX + 2PY + 8.2.4 = 136 (1)
- Số hạt mang điện trong Y ít hơn X là 4.
⇒ 2PX - 2PY = 4 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P_X=19=Z_X\\P_Y=17=Z_Y\end{matrix}\right.\)
Nguyên tử ar có ba đồng vị 40ar, 38ar, 36ar. Với nguyên tử khối tb là 39,985. Biết % số nguyên tử của 40ar là 99,604%. Tính % số nguyên tử của hai đồng vị còn lại
Đặt %số nguyên tử 38Ar : x
→ % số nguyên tử 36Ar : (100 - x - 99,604)
\(\overline{M}=\dfrac{99,604.40+x.38+\left(100-x-99,604\right).36}{100}=39,985\)
\(\Rightarrow x=0,042\)
Vậy % số nguyên tử 2 đồng vị còn lại : 38Ar : 0,042% , 36Ar : 100%-99,604%-0,042%=0,354%