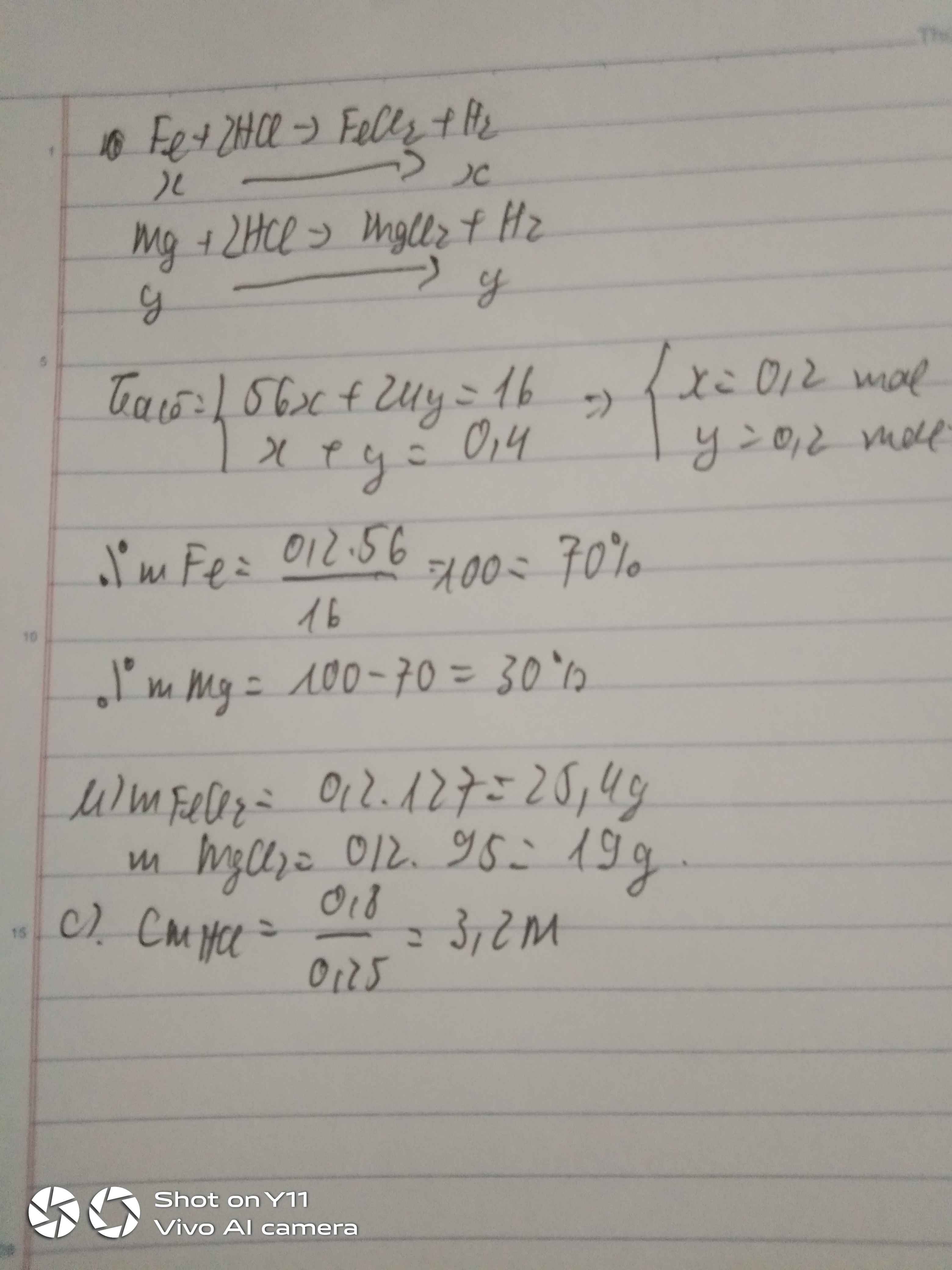Hãy tìm cách làm mất màu dung dịch brom mà KHÔNG ĐƯỢC dùng bất cứ chất khí nào.
Chủ đề 9: Axit clohiđric
Hợp chất vô cơ : Dung dịch $FeCl_2$ làm mất màu dung dịch brom
$6FeCl_2 + 3Br_2 \to 4FeCl_3 + 2FeBr_3$
Hợp chất hữu cơ : Dung dịch $CH_2=CH-CH_2-COOH$,....
$CH_2=CH-CH_2-COOH + Br_2 \to CH_2Br-CHBr-CH_2-COOH$
Đúng 4
Bình luận (0)
Có thể dùng stiren, hexen, anilin, dung dịch axetandehit, dung dịch nước clo,... để làm mất màu dung dịch brom
Đúng 2
Bình luận (0)
Có thể dùng stiren ,hexen, anilin , dung dịch axetandehit , dụng dịch nước clo,...để làm mất màu dung dịch brom
Ví dụ stiren :
\(C_6H_5CH=CH_2+Br_2\rightarrow C_6H_5CHBr-CH_2Br\)
Đúng 2
Bình luận (1)
hòa tan 20g hỗn hợp \(MgCO_3,FeCO_3,Na_2CO_3\) bằng dd HCl dư. Sau phản ứng thu được 4,48 lít khí đktc và dung dịch X. cô cạn dung dịch X thì thu được số gam muối khan là?
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2mol\Rightarrow n_{HCl}=2n_{CO_2}=2\cdot0,2=0,4mol\)
\(\Rightarrow n_{H_2O}=0,2mol\Rightarrow m_{H_2O}=3,6g\)
BTKL: \(m=m_{muối}+m_{HCl}-m_{CO_2}-m_{H_2O}\)
\(\Rightarrow20=m_{muối}+0,4\cdot36,5-0,2\cdot44-3,6\)
\(\Rightarrow m_{muối}=17,8g\)
Đúng 1
Bình luận (1)
: Cho m (g) Mg, Al vào 250 ml dd X chứa hỗn hợp HCl 1M và H2SO4 0,5M thu được 5,32 lít khí H2 ( ở đktc) và dd Y ( Coi thể tích dd không thay đổi).
a. Trong dd Y axit dư hay hết?
b. Tính giá trị m?
c. Cô cạn dd Y thu được a(g) muối. Tính a?
Hòa tan 2,74 (g) Kim loại R thuộc nhóm A vào 200ml ddHCl 0,1M thu được 0,448 lít khí H2 ( ở đktc). Xác định R?
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
\(n_{HCl}=0,1.0,2=0,02\left(mol\right)\)
Do 2nH2 > nHCl
=> HCl hết, R tác dụng với nước sinh ra H2
PTHH: 2R+ 2nHCl --> 2RCln + nH2
\(\dfrac{0,02}{n}\)<-0,02------------->0,01
2R + 2nH2O --> 2R(OH)n + nH2
\(\dfrac{0,02}{n}\)<----------------------0,01
=> \(n_A=\dfrac{0,02}{n}+\dfrac{0,02}{n}=\dfrac{0,04}{n}\left(mol\right)\)
=> \(M_R=\dfrac{2,74}{\dfrac{0,04}{n}}=68,5n\left(g/mol\right)\)
Xét n = 2 thỏa mãn: MR = 137 (g/mol)
=> R là Ba
Đúng 5
Bình luận (2)
Cho 13,44 lít khí Cl2 (đktc) qua 2,5 lít dung dịch NaOH1M. Nồng độ NaOH Sau khi phản ứng xảy ra là:
A. 0,52M. B. 0,48M. C. 0,2M. D. 0,5M.
nNaOH = 1.2,5 = 2,5 (mol)
\(n_{Cl_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2NaOH + Cl2 --> NaCl + NaClO + H2O
Xét tỉ lệ: \(\dfrac{2,5}{2}>\dfrac{0,6}{1}\) => NaOH dư, Cl2 hết
PTHH: 2NaOH + Cl2 --> NaCl + NaClO + H2O
1,2<---0,6
=> \(C_{M\left(NaOH.sau.pư\right)}=\dfrac{2,5-1,2}{2,5}=0,52M\)
=> A
Đúng 3
Bình luận (3)
Câu 3. Cho 24 gam hỗn hợp Fe và Mg tác dụng vừa đủ với dung dịch HCl 2M thì thu được 13,44 lít khí(đktc). a. Tính phần trăm về khối lượng mỗi kim loại trong hh đầu và thể tích dung dịch HCl đã dùng b. Cho dung dịch sau phản ứng tác dụng với dung dịch AgNO3 dư. Tính khối lượng kết tủa thu được.
Đọc tiếp
Câu 3. Cho 24 gam hỗn hợp Fe và Mg tác dụng vừa đủ với dung dịch HCl 2M thì thu được 13,44 lít khí(đktc).
a. Tính phần trăm về khối lượng mỗi kim loại trong hh đầu và thể tích dung dịch HCl đã dùng
b. Cho dung dịch sau phản ứng tác dụng với dung dịch AgNO3 dư. Tính khối lượng kết tủa thu được.
Fe+2HCl->FeCl2+H2
x---2x-----------x
Mg+2HCl->MgCl2+H2
y------2y-----------y
Ta có :
\(\left\{{}\begin{matrix}56x+24y=24\\x+y=\dfrac{13,44}{22,4}\end{matrix}\right.\)
=>x=0,3 mol, y=0,3 mol
=>%m Fe=\(\dfrac{0,3.56}{24}.100\)=70%
=>%m Mg=100-70=30%
=>VHCl=\(\dfrac{0,3.2+0,3.2}{2}\)=0,6l=600ml
b)
XCl2+2AgNO3->2AgCl+X(NO3)2
0,6--------------------1,2mol
=>m AgCl=1,2.143,5=172,2g
Đúng 2
Bình luận (0)
cho 43,5gam MnO2 tác dụng hết với 250gam dd HCl thu được khí A. dẫn khí A qua 400ml dd NaOH 5M thu được dd B
a) tính nồng độ mol các muối trong dd B
b) Tính C% của dd HCl ban đầu (dùng dư 10% so với phản ứng)
MnO2+4HCl->MnCl2+H2O+Cl2
0,5---------2------0,5--------0,5---0,5
Cl2+2NaOH->NaClO+NaCl+H2O
0,5-----1--------0,5----------0,5------0,5
n MnO2 =\(\dfrac{43.5}{87}\)=0,5 mol
n NaOH=5.0,4=2 mol
=>NaOH dư :0,1 mol
=>CM NaCl= CM NaClO =\(\dfrac{1}{0,4}\)=2,5M
=>CM NaOH dư =1\(\dfrac{1}{0,4}\)=2,5M
b)
C%HCl =\(\dfrac{2.36,5}{250}100\)=29,2%
dùng dư 10%
=>C%HCl=29,2+10=39,2%
Đúng 0
Bình luận (2)
Cho 16g hỗn hợp X gồm Fe và Mg tác dụng hoàn toàn với 250 ml dung dịch HCl thì thu được 8,96lit khí ở đktc.
a. Tính thành phần trăm theo khối lượng của Fe và Mg trong hỗn hợp
b. Tính khối lượng muối clorua tạo thành
c. Tính nồng độ HCl cần dùng
Cho 11 gam gồm Al,Fe tác dụng với 500ml HCl dư , thu được 8,96 lít khí (dktc).
a. Tính %m các kim loại ban đầu
b. Lượng HCl dư được trung hoà bởi 25ml dd NaOH 25% (d=1,2g/ml) tính CM của dd HCl đã dùng
a) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11 (1)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--->3a---------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b-->2b------------------>b
=> 1,5a + b = 0,4 (2)
(1)(2) => a = 0,2; b = 0,1
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11}.100\%=49,09\%\\\%m_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\end{matrix}\right.\)
b) mdd NaOH = 1,2.25 = 30 (g)
=> \(n_{NaOH}=\dfrac{30.25\%}{100}=0,075\left(mol\right)\)
PTHH: NaOH + HCl --> NaCl + H2O
0,075-->0,075
=> nHCl = 0,075 + 0,6 + 0,2 = 0,875 (mol)
=> \(C_{M\left(ddHCl\right)}=\dfrac{0,875}{0,5}=1,75M\)
a) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11 (1)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--->3a---------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b-->2b------------------>b
=> 1,5a + b = 0,4 (2)
(1)(2) => a = 0,2; b = 0,1
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11}.100\%=49,09\%\\\%m_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\end{matrix}\right.\)
b) mdd NaOH = 1,2.25 = 30 (g)
=> \(n_{NaOH}=\dfrac{30.25\%}{40}=0,1875\left(mol\right)\)
PTHH: NaOH + HCl --> NaCl + H2O
0,1875-->0,1875
=> nHCl = 0,1875 + 0,6 + 0,2 = 0,9875 (mol)
=> \(C_{M\left(ddHCl\right)}=\dfrac{0,9875}{0,5}=1,975M\)
Đúng 1
Bình luận (1)
Những tính chất nào sau đây chứng tỏ HCl có tính axit? (1): làm quỳ tím hóa đỏ. (2): tác dụng với oxit bazơ và bazơ. (3): tác dụng với muối có gốc axit yếu. (4): tác dụng với chất oxi hóa mạnh như: MnO2, KMnO4... (5): tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học. A. (2), (3), (4). B. (1), (2), (3), (5). C. (1), (2), (3), (4), (5). ...
Đọc tiếp
Những tính chất nào sau đây chứng tỏ HCl có tính axit? (1): làm quỳ tím hóa đỏ. (2): tác dụng với oxit bazơ và bazơ. (3): tác dụng với muối có gốc axit yếu. (4): tác dụng với chất oxi hóa mạnh như: MnO2, KMnO4... (5): tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học. A. (2), (3), (4). B. (1), (2), (3), (5). C. (1), (2), (3), (4), (5). D. (1), (3), (5).
Cảm ơn rất nhiều ạ
Những tính chất nào sau đây chứng tỏ HCl có tính axit? (1): làm quỳ tím hóa đỏ. (2): tác dụng với oxit bazơ và bazơ. (3): tác dụng với muối có gốc axit yếu. (4): tác dụng với chất oxi hóa mạnh như: MnO2, KMnO4... (5): tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học. A. (2), (3), (4). B. (1), (2), (3), (5). C. (1), (2), (3), (4), (5). D. (1), (3), (5).
Đúng 2
Bình luận (0)