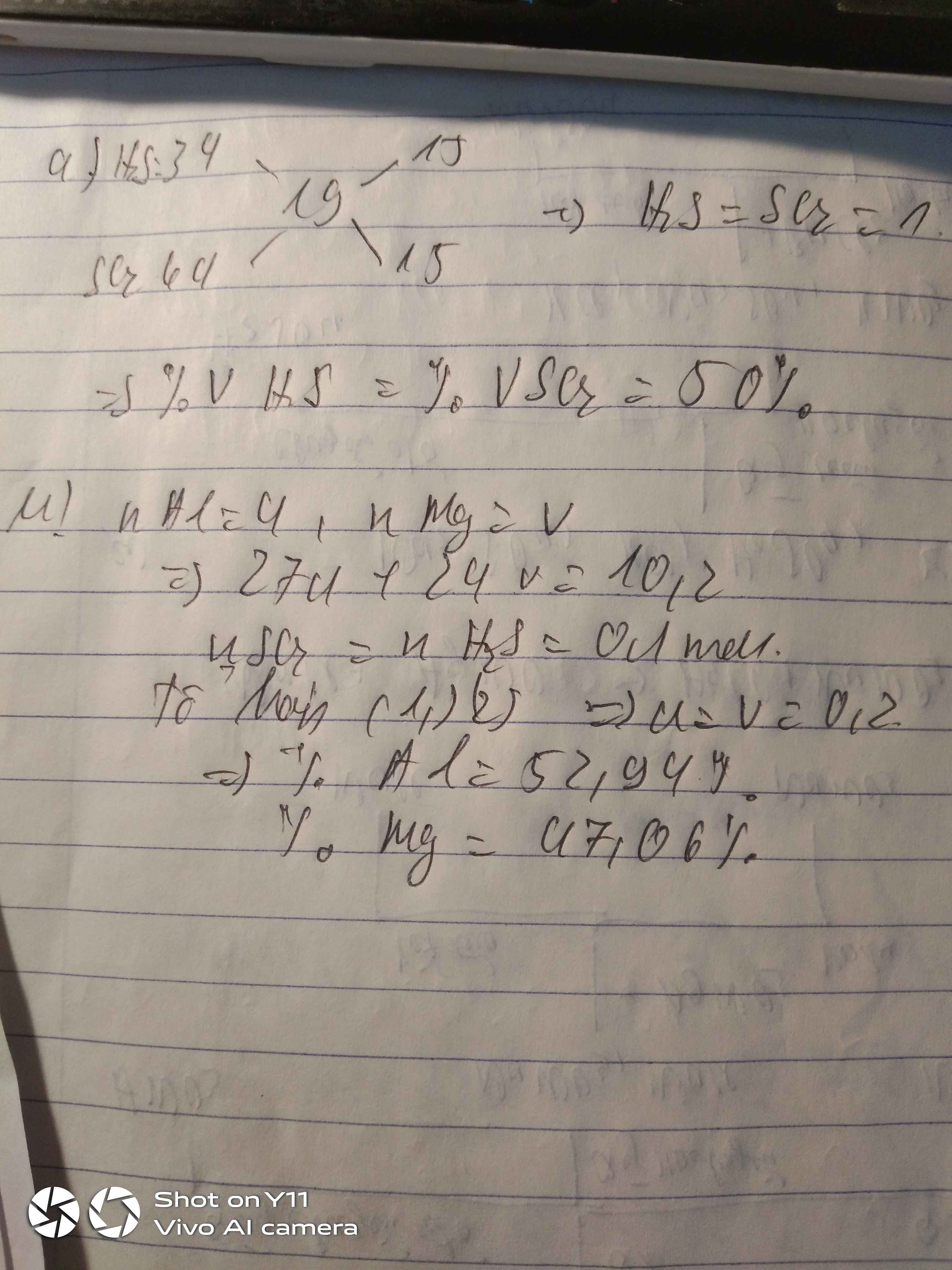Đốt cháy hoàn toàn 8,96 lít H2S (đktc) toàn bộ khí SO2 thoát ra dẫn vào 50 ml dung dịch NaOH 25% (d = 1,28g/ml ) thu được muối gì? Tính nồng độ phần trăm các chất sau phản ứng
Chủ đề 12: SO2 tác dụng với dung dịch kiềm
\(n_{H_2S}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2H2S + 3O2 --to--> 2SO2 + 2H2O
0,4--------------->0,4
\(m_{dd.NaOH}=50.1,28=64\left(g\right)\)
=> mNaOH = 64.25% = 16 (g)
=> \(n_{NaOH}=\dfrac{16}{40}=0,4\left(mol\right)\)
Xét \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,4}{0,4}=1\) => Thu được muối NaHSO3
PTHH: NaOH + SO2 --> NaHSO3
0,4------------->0,4
=> \(C\%_{NaHSO_3}=\dfrac{0,4.104}{0,4.64+64}.100\%=46,429\%\)
Đúng 3
Bình luận (0)
Khi hòa tan hết 5,28 gam hỗn hợp X gồm Al và Mg trong dung dịch H2SO4 đặc nóng, dư thu được sản phẩm chứa 6,272l lít khí SO2(đktc).a.% theo số mol của Mg trong hỗn hợp là bao nhiêu ?:b.Tìm khối lượng muối thu được sau phản ứng ?c.Dẩn khí thu được sau phản ứng vào 200ml dung dịchCa(OH)2 , ta thu được 20g kết tủa .Tìm nồng độ của dung dịch Ca(OH)2 đã dùng?d. Cũng lượng hổn hợp kim loại trên ta cho vào 200ml dung dịch H2SO4(loãng) sau phản ứng ta thu được V lít khí (đktc) ,tìm nồng độ dd H2SO4 đã...
Đọc tiếp
Khi hòa tan hết 5,28 gam hỗn hợp X gồm Al và Mg trong dung dịch H2SO4 đặc nóng, dư thu được sản phẩm chứa 6,272l lít khí SO2(đktc).
a.% theo số mol của Mg trong hỗn hợp là bao nhiêu ?:
b.Tìm khối lượng muối thu được sau phản ứng ?
c.Dẩn khí thu được sau phản ứng vào 200ml dung dịchCa(OH)2 , ta thu được 20g kết tủa .Tìm nồng độ của dung dịch Ca(OH)2 đã dùng?
d. Cũng lượng hổn hợp kim loại trên ta cho vào 200ml dung dịch H2SO4(loãng) sau phản ứng ta thu được V lít khí (đktc) ,tìm nồng độ dd H2SO4 đã dùng và V lít khí thu được sau phản ứng?
a, Gọi \(\left\{{}\begin{matrix}n_{Al}=b\left(mol\right)\\n_{Mg}=a\left(mol\right)\end{matrix}\right.\)
\(n_{SO_2}=\dfrac{6,272}{22,4}=0,28\left(mol\right)\)
PTHH:
Mg + 2H2SO4 (đ, n) ---> MgSO4 + SO2 + 2H2O
a----------------------------->a--------->a
2Al + 6H2SO4 (đ, n) ---> Al2(SO4)3 + 3SO2 + 6H2O
b----------------------------->0,5b--------->1,5b
=> hệ pt \(\left\{{}\begin{matrix}27b+24a=5,28\\a+1,5b=0,28\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\left(mol\right)\\b=0,16\left(mol\right)\end{matrix}\right.\)
=> \(\%n_{Mg}=\dfrac{0,04}{0,04+0,16}.100\%=20\%\)
b, \(\left\{{}\begin{matrix}m_{MgSO_4}=0,04.120=4,8\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,5.0,16.342=27,36\left(g\right)\end{matrix}\right.\)
=> mmuối = 4,8 + 27,36 = 32,16 (g)
c,\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\\ n_{SO_2\left(dư\right)}=0,28-0,2=0,08\left(mol\right)\)
PTHH:
Ca(OH)2 + SO2 ---> CaSO3 + H2O
0,2<---------0,2<------0,2
Ca(OH)2 + 2CO2 ---> Ca(HCO3)2
0,04<--------0,08
\(\rightarrow C_{M\left(Ca\left(OH\right)_2\right)}=\dfrac{0,2+0,08}{0,2}=1,4M\)
d, PTHH:
2Al + 3H2SO4(l) ---> Al2(SO4)3 + 3H2
0,16-->0,24------------------------->0,24
Mg + H2SO4(l) ---> MgSO4 + H2
0,04-->0,04--------------------->0,04
\(\Rightarrow\left\{{}\begin{matrix}C_{M\left(H_2SO_4\right)}=\dfrac{0,24+0,04}{0,2}=1,4M\\V_{H_2}=\left(0,24+0,04\right).22,4=6,272\left(l\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Bài 5: Hòa tan hết 16,4g hỗn hợp hai kim loại Ag và Fe trong dung dịch H2SO4 đặc nóng 10M thì ta thấy khối lượng dd tăng lên 10g đồng thời sản phẩm thu được sau phản ứng là V lít khí SO2 (ĐKTC) và 3,2 g chất rắn .a. Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu ?b. Tìm thể tích khí thu được và dd axit đã dùng ?c. Tìm khối lượng muối thu được sau phản ứng ?
Đọc tiếp
Bài 5: Hòa tan hết 16,4g hỗn hợp hai kim loại Ag và Fe trong dung dịch H2SO4 đặc nóng 10M thì ta thấy khối lượng dd tăng lên 10g đồng thời sản phẩm thu được sau phản ứng là V lít khí SO2 (ĐKTC) và 3,2 g chất rắn .
a. Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu ?
b. Tìm thể tích khí thu được và dd axit đã dùng ?
c. Tìm khối lượng muối thu được sau phản ứng ?
Bài 4: Khi hòa tan hết 10,2 gam hỗn hợp X gồm Al và Mg trong dung dịch H2SO4 đặc nóng, dư thu được sản phẩm chứa 4,48 lít hỗn hợp khí H2S và SO2 (có tỉ khối hơi so với H2 là 24,5 ).
a. Tìm % thể tích mỗi khí trong hỗn hợp thu được ?
b. Tìm % khối lượng mỗi kim loại trong hỗn hợp ban đầu ?
cho 3,2 g so2 hấp thụ hoàn toàn bởi V ml dd naoh 1M. sau phản ứng đem cô cạn dd 5,75g muối. Tính V NaOH tối thiểu phải dùng.
SO2+NaOH->NaHSO3
n So2=0,05 mol
Giả sử phản ứng tạo 1 muối NaHSO3
BTNT S: nNaHSO3 = nSO2 = 0,05 => m muối = 5,2 gam < 5,75 gam
Giả sử phản ứng tạo 1 muối Na2SO3
BTNT S: nNa2SO3 = nSO2 = 0,05 => m muối = 6,3 gam > 5,75 gam
Chứng tỏ phản ứng tạo hỗn hợp 2 muối NaHSO3 (a mol) và Na2SO3 (b mol)
\(\left\{{}\begin{matrix}a+b=0,05\\\text{104 a + 126 b = 5,75 }\end{matrix}\right.\)
a=0,025, b=0,025 mol
BTNT Na => n NaOH = 2n Na2SO3 + n NaHSO3 = 0,075 mol
VNaOH = 0,075 :1 = 0,075 lít = 75ml
Đúng 4
Bình luận (0)
SO2 + NaOH ---> \(\left[{}\begin{matrix}Na2SO3+H2O\\NaHSO3\end{matrix}\right.\)
nSO2 = \(\dfrac{3,2}{64}=0,05\left(mol\right)\)
Bảo toàn nguyên tố : nSO2 = nS (muối) = 0,05 (mol)
M (muối) = \(\dfrac{5,75}{0,05}=115\left(đvC\right)\)
Nhận thấy MNaHSO3 < M(muối) < MNa2SO3
=> Phản ứng tạo 2 muối
Gọi muối NaHSO3 là x , Na2SO3 là y
Ta có : \(\left\{{}\begin{matrix}x+y=0,05\\104x+126y=5,75\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,025\\y=0,025\end{matrix}\right.\)
Bảo toàn Na : 0,025.1 + 0,025.2 = 0,075 ( mol )
=> V NaOH = n/Cm = 75 ( ml )
Đúng 2
Bình luận (0)
GiuGiúp mình giải nhanh voi 5 hòa tan 20g hỗn hợp Al,Fe, Cu vào dung dịch H2so4 loãng dư thu được 8.92 lít H2 đkc và 9g 1 chất rắn ko tan . Tính % lượng mỗi kim loại trong hỗn hợp 6 hòa tan hoàn toàn 28.2 g hôn hợp FeS và ZnS vào lượng vua đủ dung dịch hcl thì thu được 6.72 lít khí đkc tính % lượng mỗi chất trong hỗn hợp
Bài 5:
Ta có: mCu = 9 (g)
⇒ mAl + mFe = 20 - 9 = 11 (g)
Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 11 (1)
Ta có: \(n_{H_2}=0,4\left(mol\right)\)
Theo ĐLBT mol e, có: 3x + 2y = 0,4.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{20}.100\%=27\%\\\%m_{Fe}=\dfrac{0,1.56}{20}.100\%=28\%\\\%m_{Cu}=45\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Bài 6:
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{ZnS}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 97y = 28,2 (1)
Ta có: \(n_{H_2S}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
BTNT S, có: x + y = 0,3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{0,1.88}{28,2}.100\%\approx31,2\text{% }\\\%m_{ZnS}\approx68,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Bài 5:
Chất rắn không tan là Cu => \(m_{Cu}=9\left(g\right)\)
=> \(m_{h^2\left(Al,Fe\right)}=20-9=11\left(g\right)\)
Có \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO4\right)_3+3H_2\left(1\right)\)
______a .................................................\(\dfrac{3}{2}a\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\left(2\right)\)
b.........................................b
ta có hệ: \(\left\{{}\begin{matrix}27a+56b=11\\\dfrac{3}{2}a+b=0,4\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\left(mol\right)\)
Vậy \(\%m_{Al}=\dfrac{0,2.27}{20}.100\%=27\%\)
\(\%m_{Fe}=\dfrac{0,1.56}{20}.100\%=28\%\)
\(\%m_{Cu}=100-27-28=45\%\)
Đúng 1
Bình luận (0)
Giúp mik làm nhanh 2 bài này gấp vs ạ 3 hòa tan 38.2 gam hỗn hợp 2 muối cacbonhray kim loại kiềm bằng dung dịch cho dư thu được 6.72 lít co2 (đkc) cô cận dung dịch thu được bao nhiêu gam muối khan? 4 hòa tan 10g hỗn hợp Mg và Fe trong dung dịch cho dư thấy tạo ra 5.6 lít khí đkc tinh khối lượng muối thu được
Bài 3 :
$R_2CO_3 + 2HCl \to 2RCl + CO_2 + H_2O$
n H2O = n CO2 = 6,72/22,4 = 0,3(mol)
n HCl = 2n CO2 = 0,6(mol)
Bảo toàn khối lượng :
m muối = 38,2 + 0,6.36,5 - 0,3.44 + 0,3.18 = 41,5(gam)
Bài 4 :
n H2 = 5,6/22,4 = 0,25(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
n HCl = 2n H2 = 0,5(mol)
Bảo toàn khối lượng :
m muối = 10 + 0,5.36,5 - 0,25.2 = 27,75(gam)
Đúng 1
Bình luận (0)
Giúp mik làm 1 khi đốt cháy hoàn toàn m gam kim loại m hóa trị 3 trong bình chứa 6.72 lít khí cl2 (đkc) vừa đủ thì thu được 26.7 gam muối. Xác dinh tên kim loại M tính m 2 đun nóng hỗn hợp gồm 4.6 gam Na và 4.8 gam S tính khoi lượng các chất hỗn hợp sau phản ứng
Bài 1:
Ta có: \(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo ĐLBT KL, có: mM + mCl2 = m muối
⇒ mM = 26,7 - 0,3.71 = 5,4 (g)
PT: \(2M+3Cl_2\underrightarrow{t^o}2MCl_3\)
___0,2____0,3 (mol)
\(\Rightarrow M_M=\dfrac{5,4}{0,2}27\left(g/mol\right)\)
Vậy: M là Nhôm (Al).
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Bài 2:
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PT: \(2Na+S\underrightarrow{t^o}Na_2S\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\), ta được S dư.
Theo PT: \(n_{Na_2S}=n_{S\left(dư\right)}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow n_{S\left(dư\right)}=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na_2S}=0,1.78=7,8\left(g\right)\\m_{S\left(dư\right)}=0,05.32=1,6\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
hỗn hợp X gồm Fe và Cu.cho 12 gam X tác dụng với 98 gam dd H2SO4 đặc ,đun nóng thu được 16g khì SO2 (Đktc) và dd Y
a. tính % khối lượng mỗi kim loại trong X
b.tính nồng độ % các chất có trong Y ,để biết trung hòa dd Y cần dùng 100ml dd KOH
Mong achii giúp đỡ e vì e đang cần gấp ạ!!!
a) n Fe = a(mol) ; n Cu = b(mol) ; n SO2 = 16/64 =0,25(mol)
56a + 64b = 12
Bảo toàn e : 3a + 2b = 0,25.2 = 0,5
Suy ra a =b = 0,1
%m Fe = 0,1.56/12 .100% =46,67%
%m Cu = 100% -46,67% = 53,33%
b)
Thiếu dữ kiện (thiếu nồng độ mol của KOH)
Đúng 1
Bình luận (0)
Theo gt ta có: $n_{SO_2}=0,25(mol)$
a, Gọi số mol Fe và Cu lần lượt là a;b(mol)
$\Rightarrow 56a+64b=12$
Bảo toàn e ta có: $3a+2b=0,5$
Giải hệ ta được $a=0,1;b=0,1$
Suy ra $\%m_{Fe}=46,67\%;\%m_{Cu}=53,33\%$
b, Ta có: $m_{dd}=94(g)$
$\Rightarrow \%C_{Fe_2(SO_4)_3}=21,27\%;\%C_{CuSO_4}=17,02\%$
Đề bạn thiếu nồng độ mol của KOH nên không tìm được lượng H2SO4 dư nhé!
Đúng 1
Bình luận (0)
hòa tan hỗn hợp gồm 11,2 gam bột fe 9,6 gam bột cu trong dung dịch h2so4 đặc n dư thấy thoát ra v lít khí so2 tìm giá trị v