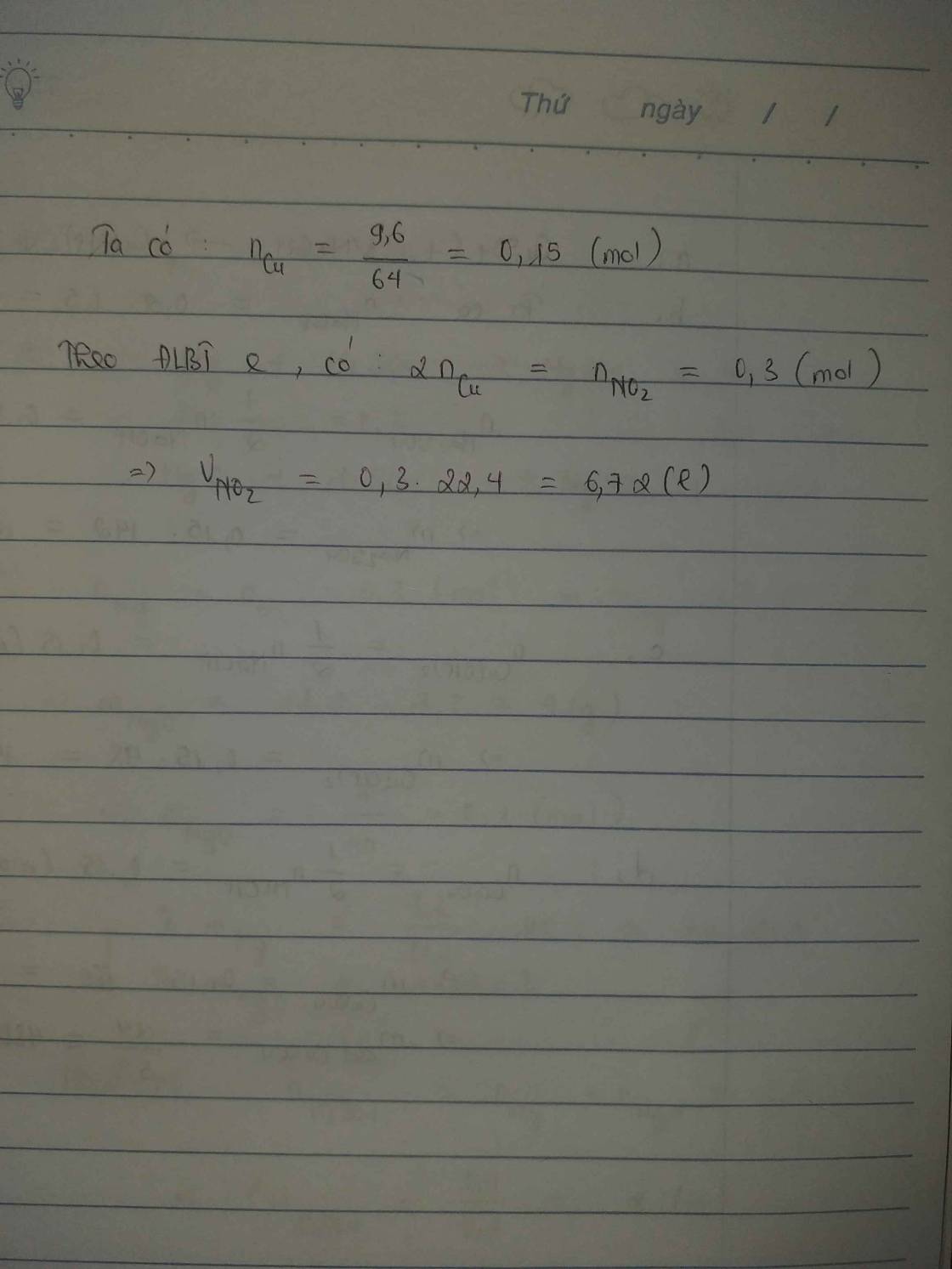Cho 4,48 lít khí N² ( đktc ) tác dụng với H² dư thứ được 1,7 gam NH³. Tính hiệu suất của phản ứng
Bài 7: Nitơ
\(n_{N_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(N_2+3H_2\underrightarrow{t^o}2NH_3\)
Theo PT: \(n_{NH_3\left(LT\right)}=2n_{N_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{NH_3\left(LT\right)}=0,4.17=6,8\left(g\right)\)
\(\Rightarrow H=\dfrac{1,7}{6,8}.100\%=25\%\)
Đúng 1
Bình luận (1)
Từ 10 m3 hỗn hợp N2 và H2 ( tỉ lệ 1 : 3 về thể tích ) với hiệu suất phản ứng tổng hợp thực tế là 95% có thể sản xuất được bao nhiêu m3 NH3
PT: \(N_2+3H_2\underrightarrow{t^o}2NH_3\)
VN2 : VH2 = 1:3
VN2 + VH2 = 10
⇒ VN2 = 2,5 m3, VH2 = 7,5 m3
Ở cùng điều kiện nhiệt độ áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
Theo PT: \(V_{NH_3\left(LT\right)}=2V_{H_2}=5\left(m^3\right)\)
Mà: H = 95% ⇒ VNH3 (TT) = 5.95% = 4,75 (m3)
Đúng 4
Bình luận (0)
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ giữ không đổi. Sau thời gian phản ứng áp suất trong bình giảm 5% so với lúc đầu. Biết N2 đã phản ứng 10% so với ban đầu. Vậy % số mol N2 và H2 trong hỗn hợp đầu là bao nhiêu( không sử dụng phương pháp giải bằng sơ đồ đường chéo nhé ! )
Đọc tiếp
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ giữ không đổi. Sau thời gian phản ứng áp suất trong bình giảm 5% so với lúc đầu. Biết N2 đã phản ứng 10% so với ban đầu. Vậy % số mol N2 và H2 trong hỗn hợp đầu là bao nhiêu
( không sử dụng phương pháp giải bằng sơ đồ đường chéo nhé ! )
Từ pV = nRT, thấy rằng khi p giảm 5% thì n giảm 5%.
\(n_{N_2}=a;n_{H_2}=b;n_{N_2pư}=0,1a\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ n_{sau}=0,95\left(a+b\right)=0,1a+0,3a+0,2a=0,6a\\ a=2,714b\\ \%V_{N_2}=\dfrac{a}{a+b}.100\%=73,07\%\\ \%V_{H_2}=26,93\%\)
Đúng 2
Bình luận (0)
Hỗn hợp A gồm N2 và H2 có phân tử khối trung bình là 7,2. Nung A với bột sắt để phản ứng tổng hợp NH3 xảy ra với hiệu suất 20% thu được hỗn hợp B. Cho B tác dụng với CuO dư, nung nóng được 32,64 gam Cu. Thể tích của hỗn hợp A được đktc( không sử dụng phương pháp giải bằng sơ đồ đường chéo nhé ! )
Đọc tiếp
Hỗn hợp A gồm N2 và H2 có phân tử khối trung bình là 7,2. Nung A với bột sắt để phản ứng tổng hợp NH3 xảy ra với hiệu suất 20% thu được hỗn hợp B. Cho B tác dụng với CuO dư, nung nóng được 32,64 gam Cu. Thể tích của hỗn hợp A được đktc
( không sử dụng phương pháp giải bằng sơ đồ đường chéo nhé ! )
\(n_{N_2}=a,n_{H_2}=b\\ M_A=\dfrac{28a+2b}{a+b}=7,2\\ a=4b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ CuO+H_2-t^{^0}->Cu+H_2O\\ n_{Cu}=n_{H_2dư}=\dfrac{32,64}{64}=0,51mol\\ n_{H_2pư}=b-0,51\left(mol\right)\\ H=\dfrac{b-0,51}{b}=0,2\\ b=0,6375\\ a=2,55\\ V_A=22,4\left(0,6375+2,55\right)=71,4L\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm N2 và H2 có overline{M_x}12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng ( hiệu suất tổng hợp NH3 đạt 40%) thu được hỗn hợp Y. overline{M_y} có giá trị là( không giải phương pháp giải bằng sơ đồ đường chéo nha mọi người ! )
Đọc tiếp
Hỗn hợp X gồm N2 và H2 có \(\overline{M_x}=12,4\). Dẫn X đi qua bình đựng bột Fe rồi nung nóng ( hiệu suất tổng hợp NH3 đạt 40%) thu được hỗn hợp Y. \(\overline{M_y}\) có giá trị là
( không giải phương pháp giải bằng sơ đồ đường chéo nha mọi người ! )
Gọi \(\left\{{}\begin{matrix}n_{N_2}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\dfrac{28x+2y}{x+y}=12,4\)
\(\Leftrightarrow12,4x+12,4y-28x-2y=0\Leftrightarrow-15,6x=-10,4y\\ \Leftrightarrow\dfrac{x}{y}=-\dfrac{10,4}{-15,6}=\dfrac{2}{3}\)
Giả sử \(\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=3\left(mol\right)\end{matrix}\right.\)
\(n_{khí.giảm}=n_{NH_3}=\dfrac{2}{3}n_{H_2}.H\%=\dfrac{2}{3}.3.40\%=0,8\left(mol\right)\)
\(n_Y=2+3-0,8=4,2\left(mol\right)\)
\(m_Y=m_X=28.2+2.3=62\left(g\right)\)
\(\overline{M_Y}=\dfrac{62}{4,2}=14,76g/mol\)
Đúng 2
Bình luận (0)
\(n_{N_2}=a;n_{H_2}=b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ M_X=\dfrac{28a+2b}{a+b}=12,4\\ a=1,5b\\ Sau.pư:\\ M_Y=\dfrac{2.0,6b+28\left(a-\dfrac{0,4b}{3}\right)+17.0,4b}{0,6b+a-\dfrac{0,4b}{3}+0,4b}=19,55\)
Đúng 1
Bình luận (0)
Viết công thức hoá học 10 hợp chất của nito
Hòa tan 9,6 gam Cu vào dd HNO3 đặc, thu được V lít khí NO2 (đktc, sản phẩm khử duy nhất). Tính giá trị của V
Bài 1. Hoàn thành các chuỗi phản ứng sau:
\(NO_2\) (1) → \(HNO_3\) (2) → \(Cu\left(NO_3\right)_2\) (3) → \(Cu\left(OH\right)_2\) (4) → \(Cu\left(NO_3\right)_2\) (5) → \(CuO\) (6) → \(Cu\)
`(1) 4NO_2 + 2H_2O + O_2 -> 4HNO_3`
`(2) HNO_3 + CuO -> Cu(NO_3)_2 + H_2O`
`(3) Cu(NO_3)_2 + 2KOH -> Cu(OH)_2 + 2KNO_3`
`(4) Cu(OH)_2 + 2HNO_3 -> Cu(NO_3)_2 + 2H_2O`
$(5) 2Cu(NO_3)_2 \xrightarrow{t^o} 2CuO + 4NO_2 + O_2$
$(6) CuO + CO \xrightarrow{t^o} Cu + CO_2$
Đúng 2
Bình luận (1)
Câu 10: Cho 1 mol khí nitơ phản ứng với H2 dư trong điều kiện phù hợp. Sau phản ứng thu được 6,8g NH3. Tính hiệu suất phản ứngCâu 11: Từ 11,2 lít N2 và 39,2 lít H2 tạo ra được 3,4 gam NH3. Tính Tính H% phản ứng (V đo ở đktc)Câu 12: Cho 2 lít N2 và 8 lít H2 vào bình phản ứng. Hỗn hợp thu được sau phản ứng có thể tích bằng 9 lít (thể tích các khí đo trong cùng điều kiện nhiệt độ và áp suất).a. Tính thể tích khí amoniac tạo thành. b. Hiệu suất phản ứng
Đọc tiếp
Câu 10: Cho 1 mol khí nitơ phản ứng với H2 dư trong điều kiện phù hợp. Sau phản ứng thu được 6,8g NH3. Tính hiệu suất phản ứng
Câu 11: Từ 11,2 lít N2 và 39,2 lít H2 tạo ra được 3,4 gam NH3. Tính Tính H% phản ứng (V đo ở đktc)
Câu 12: Cho 2 lít N2 và 8 lít H2 vào bình phản ứng. Hỗn hợp thu được sau phản ứng có thể tích bằng 9 lít (thể tích các khí đo trong cùng điều kiện nhiệt độ và áp suất).
a. Tính thể tích khí amoniac tạo thành. b. Hiệu suất phản ứng
Câu 10:
Ta có: \(n_{NH_3}=\dfrac{6,8}{17}=0,4\left(mol\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
1------------------->2
`=>` \(H=\dfrac{0,4}{2}.100\%=20\%\)
Câu 11:
Ta có: \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\n_{H_2}=\dfrac{39,2}{22,4}=1,75\left(mol\right)\\n_{NH_3}=\dfrac{3,4}{17}=0,2\left(mol\right)\end{matrix}\right.\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
0,1<-0,3<---------0,2
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{1,75}{3}\Rightarrow\) Hiệu suất phản ứng tính theo N2
`=>` \(H=\dfrac{0,1}{0,5}.100\%=20\%\)
Câu 12:
Gọi \(n_{N_2}=a\left(l\right)\left(ĐK:0< a< 2\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
a----->3a--------->2a
Sau phản ứng có: \(\left\{{}\begin{matrix}n_{N_2}=2-a\left(l\right)\\n_{H_2}=8-3a\left(l\right)\\n_{NH_3}=2a\left(l\right)\end{matrix}\right.\)
`=> 2 - a + 8 - 3a + 2a = 9`
`=> a = 0,5 (l) (TM)`
`=>` \(V_{NH_3}=2.0,5=1\left(l\right)\)
b) Xét tỉ lệ: \(\dfrac{2}{1}< \dfrac{8}{3}\Rightarrow\) Hiệu suất phản ứng tính theo N2
`=>` \(H=\dfrac{0,5}{2}.100\%=25\%\)
Đúng 2
Bình luận (0)
 Giúp mình giải câu 2 và câu 3 ạ
Giúp mình giải câu 2 và câu 3 ạ
Câu 2:
a)
(1) \(NH_4NO_2\xrightarrow[]{t^o}N_2\uparrow+2H_2O\)
(2) \(NH_4NO_2+NaOH\rightarrow NaNO_2+NH_3\uparrow+H_2O\)
(3) \(N_2+O_2\xrightarrow[]{3000^oC}2NO\)
(4) \(NH_4NO_2+Mg\xrightarrow[]{t^o}Mg_3N_2+2H_2O\)
(5) \(2NO+O_2\rightarrow2NO_2\)
(6) \(Mg_3N_2\xrightarrow[]{t^o}3Mg+N_2\)
(7) \(2NH_3+3Cl_2\rightarrow N_2+6HCl\)
b)
\(NH_4NO_2\xrightarrow[]{t^o}N_2\uparrow+2H_2O\)
$N_2 + 3H_2 \xrightarrow{t^o,p,xt} 2NH_3$
`2NH_3 + H_2SO_4 -> (NH_4)_2SO_4`
$(NH_4)_2SO_4 + BaCl_2 \rightarrow 2NH_4Cl + BaSO_4 \downarrow$
$NH_4Cl + AgNO_3 \rightarrow AgCl \downarrow + NH_4NO_3$
$NH_4NO_3 \xrightarrow{t^o} N_2O + 2H_2O$
c)
\(NH_4NO_2\xrightarrow[]{t^o}N_2\uparrow+2H_2O\)
$N_2 + 3H_2 \xrightarrow{t^o,p,xt} 2NH_3$
$4NH_3 + 5O_2 \xrightarrow[Pt]{t^o} 4NO + 6H_2O$
$2NO + O_2 \rightarrow 2NO_2$
$2NH_3 + 3CuO \xrightarrow{t^o} 3Cu + 3H_2O + N_2$
$Cu + 2H_2SO_{4(đặc)} \xrightarrow{t^o} CuSO_4 + SO_2 + 2H_2O$
$2SO_2 + O_2 \xrightarrow[V_2O_5]{t^o} 2SO_3$
`SO_3 + H_2O -> H_2SO_4`
`2NH_3 + H_2SO_4 -> 2NH_4HSO_4`
`NH_4HSO_4 + NH_3 -> (NH_4)_2SO_4`
`(NH_4)_2SO_4 + H_2SO_4 -> 2NH_4HSO_4`
d)
`NH_4NO_3 + NaOH -> NaNO_3 + NH_3 + H_2O`
$3NH_3 + 3H_2O + AlCl_3 \rightarrow Al(OH)_3 \downarrow + 3NH_4Cl$
`Al(OH)_3 + NaOH -> NaAlO_2 + 2H_2O`
$CO_2 + NaAlO_2 + 2H_2O \rightarrow Al(OH)_3 \downarrow + NaHCO_3$
$2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
Câu 3:
a) \(NaNO_2+NH_4Cl\xrightarrow[]{t^o}NaCl+N_2\uparrow+2H_2O\)
b) Ta có: \(\left\{{}\begin{matrix}n_{NaNO_2}=0,2.1,5=0,3\left(mol\right)\\n_{NH_4Cl}=0,2.2=0,4\left(mol\right)\end{matrix}\right.\)
PTHH: \(NaNO_2+NH_4Cl\xrightarrow[]{t^o}NaCl+N_2\uparrow+2H_2O\)
ban đầu 0,3 0,4
phản ứng 0,3---------->0,3
sau phản ứng 0 0,1 0,3 0,3
\(NH_4Cl\xrightarrow[]{t^o}NH_3+HCl\)
0,1-------->0,1---->0,1
`=>` \(V_{khí\left(N_2.NH_3,HCl\right)}=\left(0,1+0,1+0,3\right).22,4=11,2\left(l\right)\)
`=>` \(C_{M\left(NaCl\right)}=\dfrac{0,3}{0,2+0,2}=0,75M\)
Đúng 2
Bình luận (0)