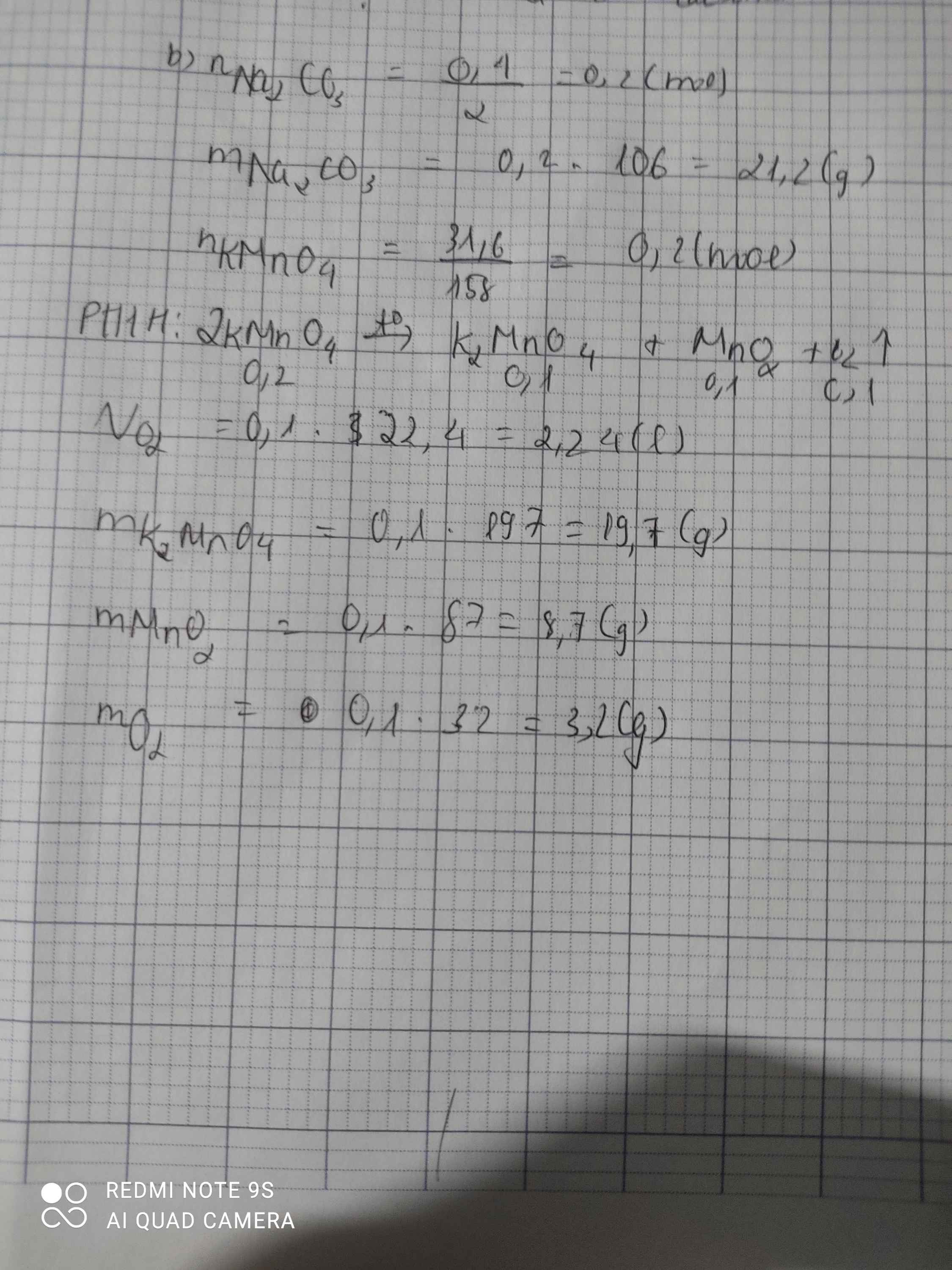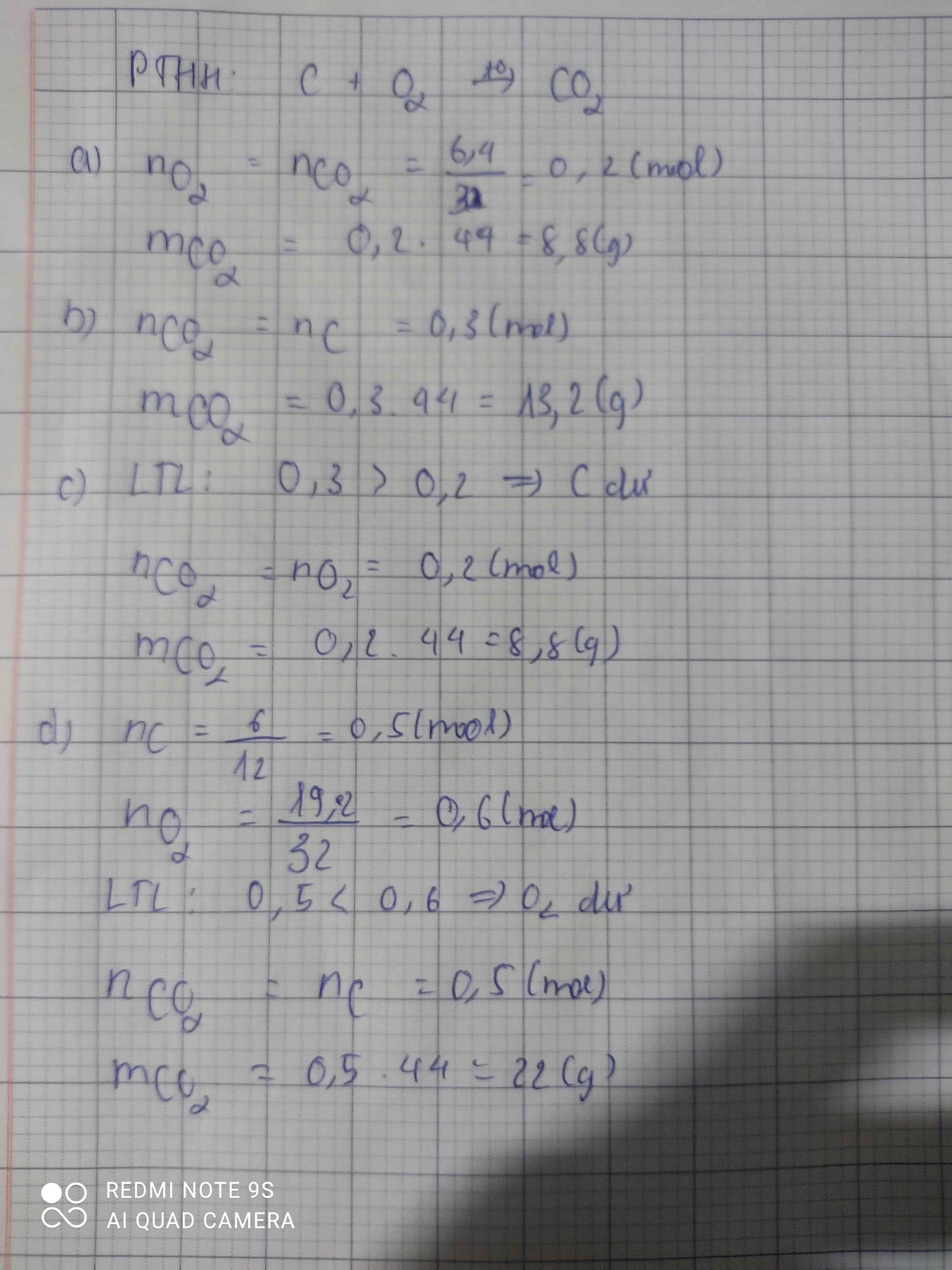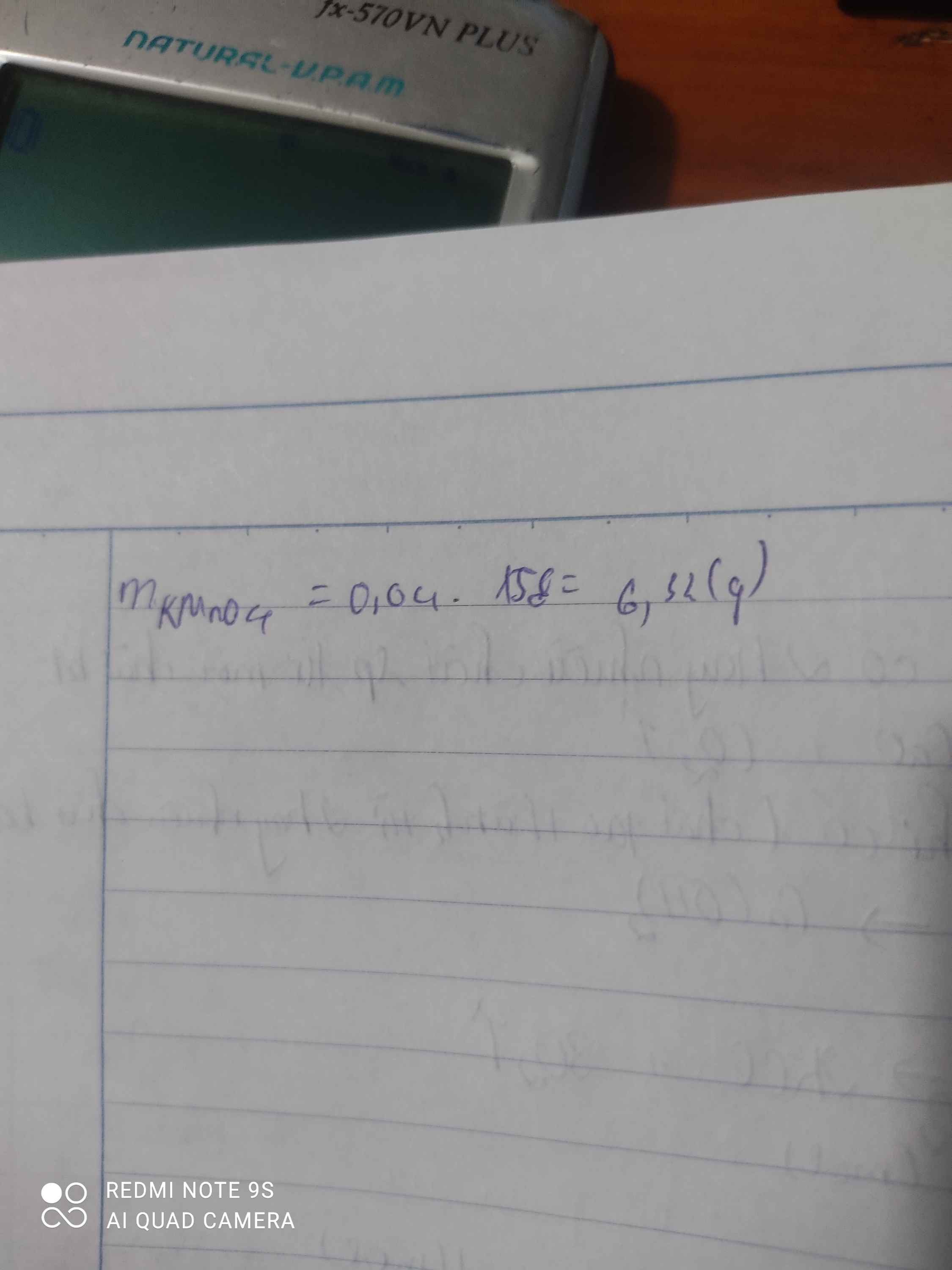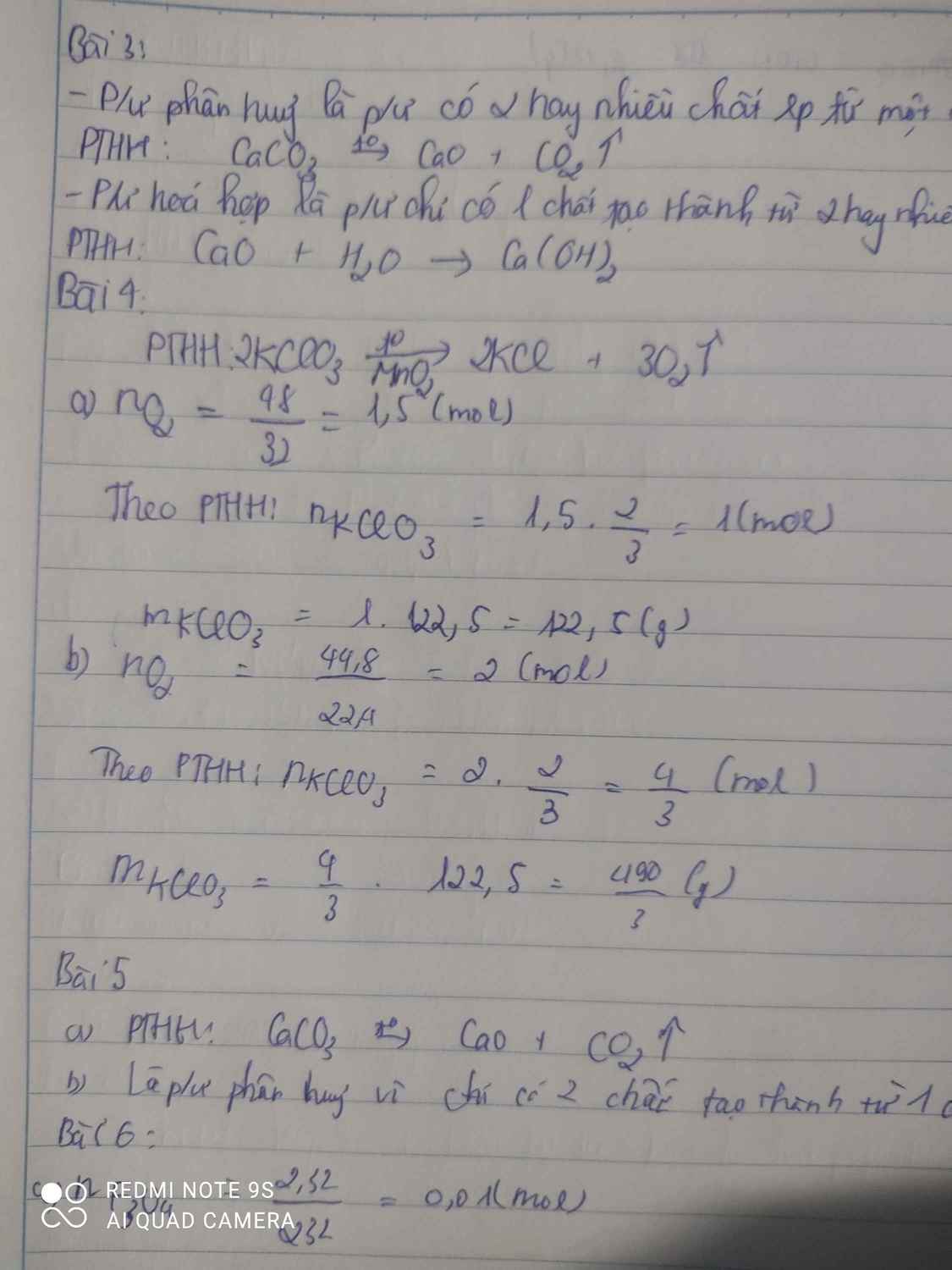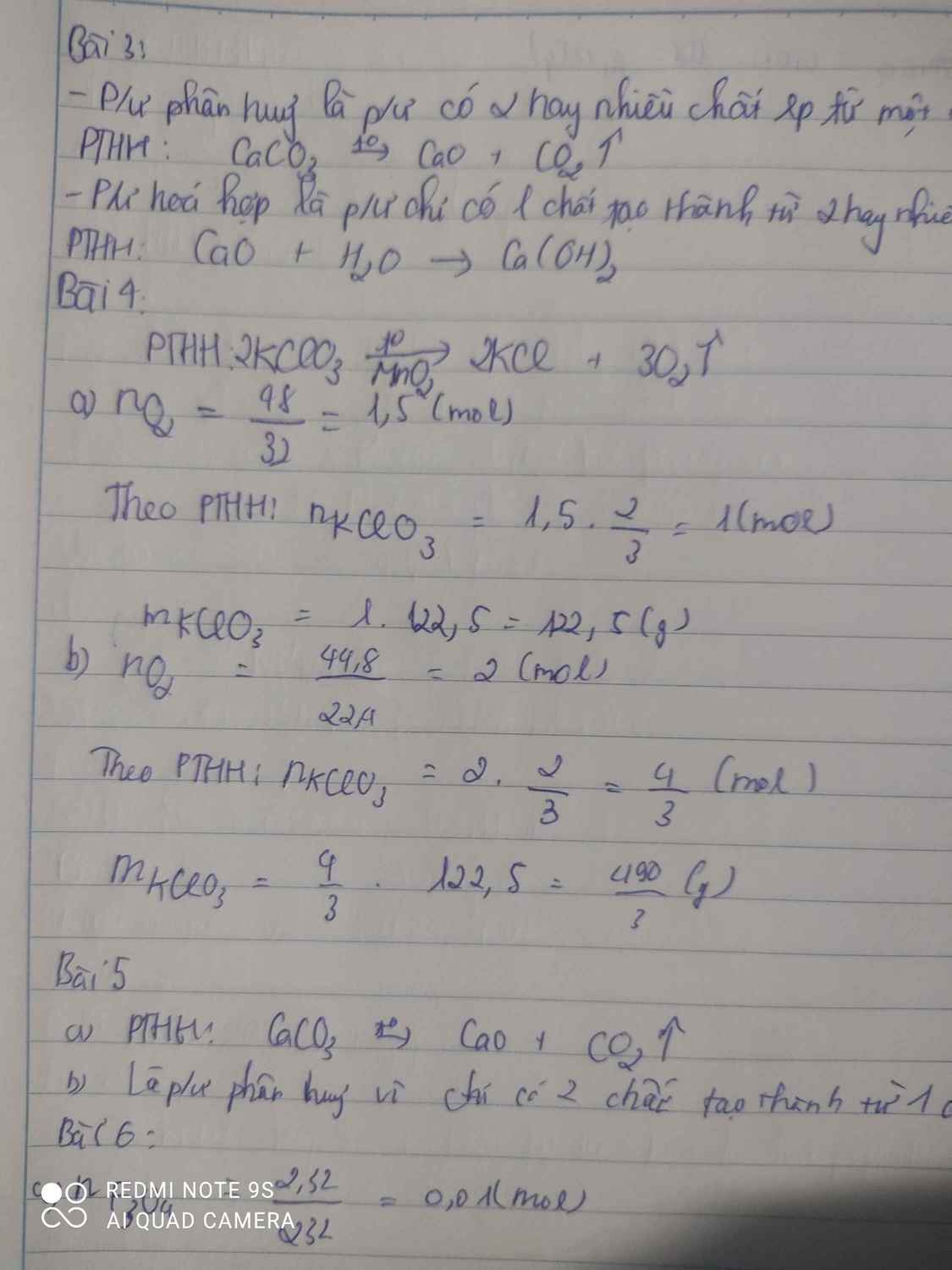a) Hãy tính thể khí oxi điều chế đe khi nung 24,5g KClO3 b) Tính khối lượng Kali clorua
Bài 27: Điều chế khí oxi-Phản ứng phân hủy
a) \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,2---------------->0,2----->0,3
=> \(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
b) \(m_{KCl}=0,2.74,5=14,9\left(g\right)\)
Đúng 4
Bình luận (0)
Nhiệt phân 31,6g KMnO4. Tính thể tích của khí O2 thoát ra, tính khối lượng các chất sau phản ứng. Em đang cần gấp ạ mong mn giúp.
\(n_{KMnO_4}=\dfrac{31,6}{158}=0,2\left(mol\right)\)
\(2KMnO_4->K_2MnO_4+MnO_2+O_2\)
2......................1................1...................1
0,2................0,1..............0,1....................0,1
\(m_{K_2MnO_4}=0,1.197=19,7\left(g\right)\\ m_{MnO_2}=0,1.87=8,7\left(g\right)\\ m_{O_2}=0,1.32=3,2\left(g\right)\)
Đúng 2
Bình luận (4)
2KMnO4-to>K2MnO4+MnO2+O2
0,2---------------0,1----------0,1-----0,1 mol
n KMnO4=\(\dfrac{31,6}{158}\)=0,2 mol
=>VO2=0,1.22,4=2,24l
=>m MnO2=0,1.87=8,7g
=>m K2MnO4=0,1.197=19,7g
Đúng 1
Bình luận (1)
Làm sao để biết được một bài toán (hóa) là bài tập lượng dư?
bạn chỉ cần tính số mol hai chất tham gia phản ứng rồi lấy hai số đó chia cho hệ số tỉ lệ trong PTHH, nếu chất nào cao hơn thì chất đó dư
Đúng 4
Bình luận (1)
Khi đề cho những dữ kiện liên quan đến tất cả những chất tham gia
Đúng 1
Bình luận (1)
Cacbon cháy trong bình đựng khí oxi tạo thành khí cacbonic. Viết PTHH và tính khối lượng khí cacbonic sinh ra trong mỗi trường hợp sau: a. Khi có 6,4g khí oxi tham gia phản ứng b. Khi có 0,3 mol cacbon tham gia phản ứng c. Khi đốt 0,3 mol cacbon trong bình đựng 0,2 mol khí oxi d. Khi đốt 6gam cacbon trong bình đựng 19,2 gam khí oxi
Bài 4: Tính số mol và số gam kali clorat cần thiết để điều chế được: a) 48g khí oxi.b) 44,8 lít khí oxi (ở đktc). Bài 6: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao. a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMn...
Đọc tiếp
Bài 4: Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc). Bài 6: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc).
Chú ý các bạn ko chép mạng nha tại mình xem rồi mà chx hiểu nên mình mới hỏi
a) \(n_{O_2}=\dfrac{48}{32}=1,5\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
1<--------------------1,5
=> \(n_{KClO_3}=1\left(mol\right)\)
=> \(m_{KClO_3}=1.122,5=122,5\left(g\right)\)
b) \(n_{O_2}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{4}{3}\)<-------------------2
=> \(n_{KClO_3}=\dfrac{4}{3}\left(mol\right)\)
=> \(m_{KClO_3}=\dfrac{4}{3}.122,5=\dfrac{490}{3}\left(g\right)\)
Đúng 2
Bình luận (2)
Đốt cháy hoàn toàn 5,4 g al trong khí xoi thu đc nhôm axit A, viết pghh xảy ra B, tính thể tích khí xoi cần dùng C để điều chế đc lượng xoi trên cần dùng bao nhiêu cần kmno4
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\a, PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{O_2}=\dfrac{3}{4}.n_{Al}=\dfrac{3.0,2}{4}=0,15\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ c,2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ n_{KMnO_4}=2.n_{O_2}=2.0,15=0,3\left(mol\right)\\ \Rightarrow m_{KMnO_4}=158.0,3=47,4\left(g\right)\)
Đúng 3
Bình luận (0)
PxO5+H2O -> ?
Vận dụng quy tắc hoá trị lập công thức hoá học (lập nhanh) và cho biết phân tử khối của các hợp chất tạo bởi: a) S (IV) và O(II) b) K(I) và nhóm (CO3 ) (II) c) Fe( II) và Cl(I)
a.\(SO_2,\) \(M=32+16\times2=64\)đvC
b.\(K_2CO_3,\) \(M=39\times2+12+16\times3=138\)đvC
c.\(FeCl_2,\)\(M=56+35.5\times2=127\)đvC
Đúng 1
Bình luận (0)
Nhận xét nào sau đây là không đúng?
A.CaO là oxit bazơ | B. NO là oxit axit |
C.Al2O3 là oxit lưỡng tính | D. CO là oxit không tạo muối |