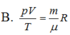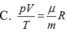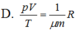Các câu hỏi tương tự
Người ta nung nóng đẳng áp 100gam khí H2 từ 22 ° C đến 122 ° C .
Tính công mà khí đã thực hiện. Biết H2 có μ = 2 ; lấy R = 8,31 J/mol.K.
Người ta nung nóng đẳng áp 100 gam khí H2 từ 22 oC đến 122 oC. Tính công mà khí đã thực hiện. Biết H2 có μ 2; lấy R 8,31 J/mol.K. A. 41150J B. 79215J C. 8014J D. 70122J
Đọc tiếp
Người ta nung nóng đẳng áp 100 gam khí H2 từ 22 oC đến 122 oC. Tính công mà khí đã thực hiện. Biết H2 có μ = 2; lấy R = 8,31 J/mol.K.
A. 41150J
B. 79215J
C. 8014J
D. 70122J
Phương trình trạng thái khí lí tưởng có dạng p.V = a.R.T với R = 8,31J/mol.K. Trong đó a là:
A. Số phân tử khí trong thể tích V
B. Số kg khí trong thể tích V.
C. Hằng số Avôgađrô.
D. Số mol khí trong thể tích V.
Người ta đốt nóng cho dãn nở đẳng áp 20 g ôxi ở áp suất 2,8 at và nhiệt độ 27 oC đến thể tích 8 lít. Cho ôxi có μ 32g/mol, lấy R 8,31J/mol.K, nhiệt dung riêng đẳng áp Cp 0,91.103 J/kg.K; 1at 9,81.104N/m2. Độ biến thiên nội năng của khí trong quá trình dãn nở là: A. 2010J B. 1510J C. 1601,07J D. 2510J
Đọc tiếp
Người ta đốt nóng cho dãn nở đẳng áp 20 g ôxi ở áp suất 2,8 at và nhiệt độ 27 oC đến thể tích 8 lít. Cho ôxi có μ = 32g/mol, lấy R = 8,31J/mol.K, nhiệt dung riêng đẳng áp Cp = 0,91.103 J/kg.K; 1at = 9,81.104N/m2. Độ biến thiên nội năng của khí trong quá trình dãn nở là:
A. 2010J
B. 1510J
C. 1601,07J
D. 2510J
Làm thí nghiệm người ta thấy bình chứa 1kg khí nitơ bị nổ ở nhiệt độ 350 ° C. Tính khối lượng khí hiđrô có thế chứa trong bình cùng loại nếu nhiệt độ tối đa bị nổ là 50 ° C và hệ số an toàn là 5, nghĩa là áp suất tối đa chỉ bằng 1/5 áp suất gây nổ. Cho H = 1; N = 14; R = 8,31J/mol.K.
Làm thí nghiệm người ta thấy bình chứa 1kg khí nitơ bị nổ ở nhiệt độ 3500C. Tính khối lượng khí hiđrô có thể chứa trong bình cùng loại nếu nhiệt độ tối đa bị nổ là 500C và hệ số an toàn là 5, nghĩa là áp suất tối đa chỉ bằng 1/5 áp suất gây nổ. Cho H = 1; N = 14; R = 8,31J/mol.K.
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép: A.
p
V
T
m
μ
R
B.
p
V
T
m
μ
R
C.
p...
Đọc tiếp
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép:
A. p V T = m μ R
B. p V T = m μ R
C. p V T = μ m R
D. p V T = μ m R
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép: A.
pVT
m
μ
R
B.
pV
T
m
μ
R
C. ...
Đọc tiếp
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép:
A. pVT = m μ R
B. pV T = m μ R
C. pV T = μ m R
D. pV T = 1 μm R
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép:
Đọc tiếp
Gọi p, V, T là các thông số trạng thái, m là khối lượng khí, µ là khối lượng mol của khí và R là hằng số của khí lí tưởng. Phương trình Cla-pê-rôn-Men-đê-lê-ép:
![]()