Bài 9: Axit nitric - Muối nitrat
Nội dung lý thuyết
Các phiên bản khácA. AXIT NITRIC
I. CẤU TẠO PHÂN TỬ
Axit nitric HNO3 có công thức cấu tạo:
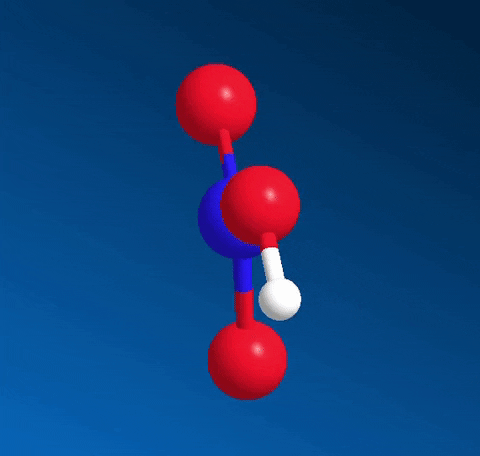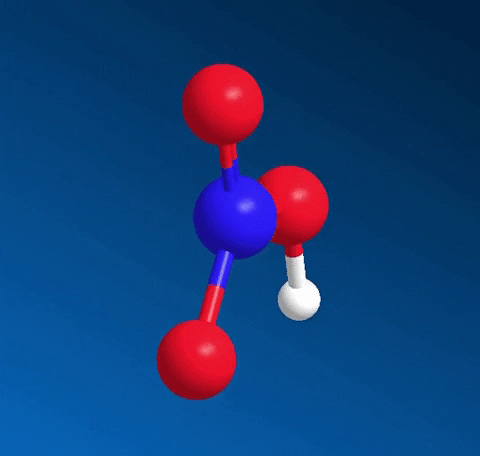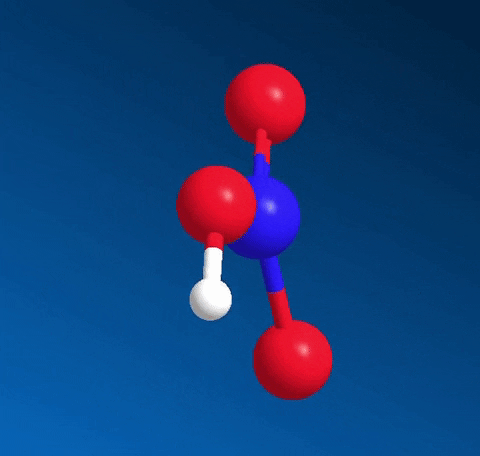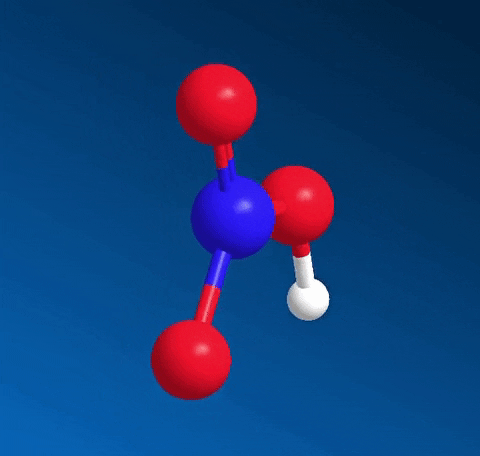
Nitơ tạo một liên kết cho nhận với 1 nguyên tử oxi thể hiện bằng dấu mũi tên, cặp electron liên kết chỉ do nguyên tử nitơ cung cấp.
Trong HNO3, nitơ có số oxi hóa cao nhất là +5.
II. TÍNH CHẤT VẬT LÍ
- Axit nitric tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm.
- Axit nitric kém bền, ở điều kiện thường bị phân hủy một phần giải phóng khí nitơ đioxit. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
- Axit nitric tan trong nước với bất kì tỉ lệ nào.

III. TÍNH CHẤT HÓA HỌC
1. Tính axit
Axit nitric là một trong các axit mạnh nhất, trong dung dịch loãng nó phân li hoàn toàn thành ion H+ và ion NO3-. Dung dịch HNO3 làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo ra muối nitrat.
CuO + HNO3 → Cu(NO3)2 + H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
2. Tính oxi hóa
Axit nitric là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử mà HNO3 có thể bị khử đến những sản phẩm khử khác nhau của nitơ.

a. Tác dụng với kim loại
Axit nitric oxi hóa được hầu hết các kim loại, kể cả kim loại có tính khử yếu như Cu, Ag..., trừ Pt và Au. Khi đó, kim loại bị oxi hóa đến mức oxi hóa cao nhất và tạo ra muối nitrat.
Cu + HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
Cu + HNO3 loãng → Cu(NO3)2 + 2NO + 4H2O
Với các kim loại có tính khử mạnh như Mg, Al, Zn,... HNO3 loãng có thể bị khử thành N2O, N2 hoặc NH4NO3.
Các kim loại như Al, Cr, Fe bị thụ động trong dung dịch HNO3 đặc nguội, do tạo ra một lớp màng oxit bền, bảo vệ cho kim loại khỏi tác dụng của các axit.
b. Tác dụng với phi kim
Khi đun nóng, HNO3 đặc có thể oxi hóa được các phi kim như C, S, P...
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
C + 4HNO3 → CO2 + 4NO2 + 2H2O
Phản ứng của HNO3 với S.
c. Tác dụng với hợp chất
HNO3 đặc còn oxi hóa được nhiều hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông... bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
@1366743@@1366903@
IV. ỨNG DỤNG
- Phần lớn axit nitric được sản xuất ra dùng để điều chế phân đạm NH4NO3, Ca(NO3)2...
- Một lượng nhỏ axit nitric dùng để sản xuất thuốc nổ, thuốc nhuộm, dược phẩm...
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Để điều chế một lượng nhỏ axit nitric trong phòng thí nghiệm, người ta đun hỗn hợp natri nitrat hoặc kali nitrat rắn với axit sunfuric:
Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó.
2. Trong công nghiệp
Axit nitric được sản xuất trong công nghiệp với 3 giai đoạn:
- Oxi hóa khí amoniac bằng oxi không khí thành nitơ mono oxit (NO):
NH3 + O2 \(\underrightarrow{850-900^oC,Pt}\) 4NO + 6H2O △H < 0
- Oxi hóa nitơ monooxit thành nitơ đioxit bằng oxi không khí ở điều kiện thường:
2NO + O2 → 2NO2
- Nitơ đioxit tác dụng với nước vào oxi tạo thành axit nitric:
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch HNO3 thu được có nồng độ từ 52 - 68%. Để có axit nitric với nồng độ cao hơn, người ta chưng cất axit này với H2SO4 đậm đặc.
@1366646@
B. MUỐI NITRAT
Muối nitrat là muối của axit nitric, ví dụ: natri nitrat NaNO3, amoni nitrat NH4NO3...
I. TÍNH CHÁT CỦA MUỐI NITRAT
1. Tất cả các muối nitrat đều dễ tan trong nước và là chất điện li mạnh. Trong dung dịch loãng, chúng phân li hoàn toàn thành các ion. Ví dụ:
NaNO3 → Na+ + NO3-
2. Phản ứng nhiệt phân
Các muối nitrat dễ bị nhiệt phân hủy, giải phóng khí oxi.
- Đối với các muối nitrat của kim loại hoạt động mạnh như kali, natri... bị phân hủy thành muối nitrit là O2.
2KNO3 \(\underrightarrow{t^o}\) 2KNO2 + O2
- Muối nitrat của magie, kẽm, sắt, chì, đồng,... bị phân hủy tạo ra oxit của kim loại tương ứng, NO2 và O2.
2Cu(NO3)2 \(\underrightarrow{t^o}\) 2CuO + 4NO2 + O2
- Muối nitrat của bạc, vàng, thủy ngân,... bị phân hủy thành kim loại tương ứng, NO2 và O2.
2AgNO3 \(\underrightarrow{t^o}\) 2Ag + 2NO2 + O2
3. Nhận biết ion nitrat
Trong môi trường trung tính, ion NO3- không có tính oxi hóa. Trong môi trường axit, ion NO3- thể hiện tính oxi hóa giống như HNO3, vì vậy để nhận biết ion NO3-, người ta thêm vào dung dịch một ít vụn đồng và dung dịch H2SO4 loãng rồi đun nóng nhẹ.
Hiện tượng: Phản ứng tạo thành dung dịch có màu xanh, có khí không màu NO thoát ra và hóa nâu trong không khí do tác dụng với O2 trong không khí tạo thành khí NO2.
3Cu + 8H+ + 2NO3- \(\underrightarrow{t^o}\) 3Cu2+ + 2NO + 4H2O
2NO + O2 → 2NO2
@1366808@
II. ỨNG DỤNG
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm): NH4NO3, NaNO3, KNO3, Ca(NO3)2...
- Kali nitrat còn được sử dụng để điều chế thuốc nổ đen. Thuốc nổ đen chứa 75% KNO3, 10%S và 15%C.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn