Khử 4,64 gam một oxit kim loại M cần dùng1,792 lit hỗn hợp CO H2(đktc).Lấy toàn bộ lượng kim loại M thu được cho tác dụng với H2SO4 đặc nóng dư giải phóng ra 20,16 lit SO2(đktc).Xác định hoá học của M và oxit của nó.
Chuyên đề mở rộng dành cho HSG
\(CO + O_{oxit} \to CO_2\\ H_2 + O_{oxit} \to H_2O\\ n_O = n_{CO} + n_{H_2} = \dfrac{1,792}{22,4} = 0,08(mol)\\ \Rightarrow m_M = 4,64 - 0,08.16 = 3,36(gam)\\ n_{SO_2} = \dfrac{20,16}{22,4} = 0,9(mol)\)
Gọi n là hóa trị cao nhất của kim loại M
Bảo toàn e : \(n.n_M = 2n_{SO_2}\Rightarrow n_M = \dfrac{1,8}{n}mol\\ \Rightarrow M = \dfrac{3,36}{\dfrac{1,8}{n}} = \dfrac{28}{15}n\)
Với n = 1,n=2 hoặc n=3 thì M không có giá trị nguyên.
(Sai đề)
Đúng 1
Bình luận (2)
Like và follow fanpage để cập nhật những tin tức mới nhất về cuộc thi nha. Các bạn hãy giúp đỡ chúng mình phát triển cuộc thi :Cuộc thi Toán Tiếng Anh VEMC | FacebookNếu bạn muốn đề xuất câu hỏi xuất hiện trong chuyên mục này các bạn hãy gửi qua form để nhận được sự ưu tiên giúp đỡ đến từ cộng đồng :[Tiền sự kiện 1] Thử sức trí tuệ - Google Biểu mẫu-------------------------------------------------------------------[Hóa.C20 _ 20.1.2021]Người biên soạn câu hỏi: Đỗ Quang TùngCông thức C2H15 ứng với...
Đọc tiếp
Like và follow fanpage để cập nhật những tin tức mới nhất về cuộc thi nha. Các bạn hãy giúp đỡ chúng mình phát triển cuộc thi :>
Cuộc thi Toán Tiếng Anh VEMC | Facebook
Nếu bạn muốn đề xuất câu hỏi xuất hiện trong chuyên mục này các bạn hãy gửi qua form để nhận được sự ưu tiên giúp đỡ đến từ cộng đồng :>
[Tiền sự kiện 1] Thử sức trí tuệ - Google Biểu mẫu
-------------------------------------------------------------------
[Hóa.C20 _ 20.1.2021]
Người biên soạn câu hỏi: Đỗ Quang Tùng
Công thức C2H15 ứng với 3 chất A, B, C có công thức cấu tạo khác nhau trong 3 chất này khi tác dụng với Cl2 có ánh sáng: chất A tạo ra 4 dẫn xuất monoclo, chất B chỉ ra 1 dẫn xuất duy nhất, chất C tạo ra dẫn suất monoclo. Các chất A, B, C là gì?
[Hóa.C21 _ 20.1.2021]
Người biên soạn câu hỏi: Nguyễn Bình An
Khi được yêu cầu cách trình bày cách pha chế 50ml dung dịch CuSO4 0,1M, một bạn học sinh đã làm như sau:
"Cần 1,25g bột CuSO4.5H2O cho vào cốc thủy tinh có chia vạch dung tích 100ml, dùng ống đong để đong 50ml nước và đổ vào cốc, khuấy đều cho tan. Ta thu được 50ml dung dịch CuSO4 nồng độ 0,1M."
Hãy cho biết bạn học sinh trên có chính xác không? Hãy sửa lại lỗi sai (nếu có).
Câu 21 :
Bạn học sinh trên làm không chính xác. Lỗi sai ở chỗ là bạn học sinh quên rằng trong CuSO4.5H2O cũng có chứa nước.
\(n_{CuSO_4.5H_2O} = n_{CuSO_4} = 0,1.0,05 = 0,005(mol)\)
\(\Rightarrow n_{H_2O} = 0,005.5 = 0,025(mol)\\ m_{H_2O} = 0,025.18 = 0,45(gam)\\\Rightarrow V_{H_2O} = \dfrac{m}{D} = \dfrac{0,45}{1} = 0,45(ml) \)
Thể tích nước cần thêm : \(V_{nước} = 50 - 0,45 = 49,55(ml)\)
Đúng 5
Bình luận (2)
C20: Bạn nào đưa đề mà sai nhiều chổ thế nhỉ C5H12 , 4 dẫn xuất , 1 dẫn xuất và 3 dẫn xuất nhé.
Chất A + Cl2 => 4 dẫn xuất
=> A là : Chất thứ hai
Chất B + Cl2 => 3 dẫn xuất
=> B là : Chất thứ nhất
Cuối cùng là C
Đúng 3
Bình luận (5)
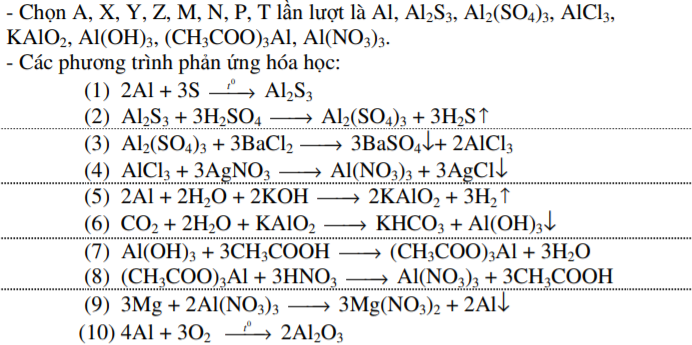
Chọn các chất thích hợp và viết phương trình pứ hoàn thành dãy chuyển hóa sau : A X Y Z M N P T A oxit của A biết A là kim loại màu trắng bạc , có hóa trị không đổi. X,Y,Z,M,N,P,T là các hợp chất khác nhau của A
Đọc tiếp
Chọn các chất thích hợp và viết phương trình pứ hoàn thành dãy chuyển hóa sau :
biết A là kim loại màu trắng bạc , có hóa trị không đổi. X,Y,Z,M,N,P,T là các hợp chất khác nhau của A
A là 1 oxit của K có PTK = 142 và tỉ lệ số nguyên tử là 1 : 2. B là oxit của Na có PTK = 78 và có tỉ lệ số nguyên tử là 1 : 1. Tìm 2 CT oxit trên
CTHH của A: (AO2)n (n nguyên,dương)
Ta có : \(M_{(AO_2)_n} = (A + 32).n = 142 \Rightarrow A = \dfrac{142-32n}{n}\)
Với n = 2 thì A = 39(Kali)
CTHH của B: (NaO)m (m nguyên,dương)
Ta có : \(M_{(NaO)_m} = (23 + 16)m = 78 \Rightarrow m = 2\)
Vậy CTHH của hai oxit là K2O4 và Na2O2
Đúng 1
Bình luận (0)
cho 40,8g hỗn hợp cu và fe3o4 tác dụng với 200ml dung dịch hno3 loãng đến khi phản ứng xảy ra hoàn toàn thu được 2,912 lit NO duy nhất ở đktc, dung dịch B và phần kim loại không tan C. Hòa tan C trong dung dịch HNO3 loãng thì thu được 0,392 lit khí NO ở đktc.
a) Tính nồng độ mol của dung dịch HNO3 đã dùng
b) Tính khối lượng các muối thu được trong dung dịch B.
a)
Chất rắn C : Cu
Bảo toàn e :
\(2n_{Cu\ dư} = 3n_{NO}\\ \Rightarrow n_{Cu\ dư} = \dfrac{0,0175.3}{2} = 0,02625(mol)\)
Gọi
\(n_{Cu\ pư} = a; n_{Fe_3O_4} = b\\ \Rightarrow 64a + 232b = 40,8 - 0,02625.64 = 39,12(1)\)
Bảo toàn e :
\(2n_{Cu} = 2n_{Fe_3O_4} + 3n_{NO}\\ \Rightarrow 2a - 2b = 0,13.3(2)\)
Từ (1)(2) suy ra a = 0,285 ; b = 0,09
Suy ra \(n_O = 4n_{Fe_3O_4} = 0,09.4 = 0,36(mol)\)
\(2H^+ + O^{2-} \to H_2O\\ 4H^+ + NO_3^- \to NO + 2H_2O\)
\(Suy\ ra\ :n_{HNO_3} = 2n_O + 4n_{NO} = 1,24(mol)\\ \Rightarrow C_{M_{HNO_3}} = \dfrac{1,24}{0,2} = 6,2M\)
b)
Muối gồm :
Cu(NO3)2 : 0,285
Fe(NO3)2 : 0,09.3 = 0,27(mol)
\(\Rightarrow m_{muối} = 0,285.188 + 0,27.180 = 102,18(gam)\)
Đúng 1
Bình luận (4)
mong mng không giải bảo toàn electron vì mình chưa học :'(
Đúng 0
Bình luận (2)
Viết phương trình hóa học minh họa: Tính axit của H2SO3 mạnh hơn H2CO3
\(Na_2CO_3 + SO_2 + \to Na_2SO_3 + CO_2 \)
Đúng 0
Bình luận (0)
PTHH: \(Na_2SO_3+2H_2O+2CO_2\rightarrow H_2SO_3+2NaHCO_3\)
Đúng 0
Bình luận (1)
Hòa tan hoàn toàn một mẫu quặng Đolomit (CaCO3.MgCO3) bằng dung dịch HCl 1M thu được 2,24 lít khí không màu. Để tác dụng hết các chất có trong dung dịch tạo thành, người ta phải dùng 120 ml dung dịch NaOH 1M. Tính thể tích dung dịch HCl 1M đã sử dụng cho thí nghiệm trên
\(n_{CO_2} = 0,1(mol)\)
CaCO3.MgCO3 + 4HCl → CaCl2 + MgCl2 + 2CO2 + 2H2O(1)
........0,05...............0,2.......................0,05.......0,1..........................(mol)
\(n_{NaOH}= 0,12(mol)\)
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl(2)
..0,1...........0,2.................................................(mol)
HCl + NaOH → NaCl + H2O(3)
0,02.....0,02................................(mol)
Theo PTHH (1)(3) suy ra :
\(n_{HCl} = 0,2 + 0,02 = 0,22(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,22}{1} = 0,22(lít)\)
Đúng 1
Bình luận (0)
Cho 400g dung dịch H2SO4 loãng táo dụng hết 6,5g
a,tính thể tích khí thoát ra (đktc)
b, Tính C% của dung dịch axit đã dùng
Xem chi tiết
Cho 0,78 hỗn hợp gồm Mg,Al vào dung dịch chứa 0,05 mol H2SO4 . Thêm tiếp 0,11 mol NaOH thấy sinh ra 1,36g kết tủa, Xác định thành phần hóa học hỗn hợp ban đầu.
Gọi \(n_{Mg} = a(mol) ; n_{Al} = b(mol)\)
Ta có : 24a + 27b = 0,78(1)
\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\)
Theo PTHH : \(n_{H_2SO_4\ pư} = a + 1,5b(mol)\)
\(\Rightarrow n_{H_2SO_4\ dư} = 0,05 - a - 1,5b(mol)\)
\(2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ \)
\(MgSO_4 + 2NaOH \to Mg(OH)_2 + Na_2SO_4\)
a..............2a................a............................(mol)
\(Al_2(SO_4)_3 + 6NaOH \to 2Al(OH)_3 + 3Na_2SO_4\)
0,5b.................3b................b...............................(mol)
\(Al(OH)_3 + NaOH \to NaAlO_2 + 2H_2O\)
c......................c.........................................(mol)
Ta có :
\(n_{NaOH} = (0,05 - a -1,5b).2 + 2a + 3b + c = 0,11\)(2)
\(m_{kết tủa} = 58a + (b - c).78 = 1,36(gam)\)(3)
(1)(2)(3) suy ra : a = 0,01 ; b = 0,02 ; c = 0,01
Vậy :
\(\%m_{Mg} = \dfrac{0,01.24}{0,78}.100\% = 30,77\%\\ \%m_{Al} = 100\% -30,77\% = 69,23\%\)
Đúng 1
Bình luận (1)
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R
Đọc tiếp
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R

Chào bạn tuy không thể giúp bạn nhưng cho mình hỏi bạn có bị mất thanh thông báo tin nhắn như mình không ạ
Đúng 0
Bình luận (3)
Oxit kim loại R : \(R_2O_n\)
\(n_{Fe_2O_3} = a(mol) ; n_{R_2O_n} = b(mol)\\ \Rightarrow 160a + b(2R + 16n) = 70,25(1)\)
\(n_{CO} = n_{CO_2} = 0,15(mol)\)
\(CO + O_{oxit} \to CO_2\)
\(n_{O\ pư} = n_{CO_2} = 0,15(mol)\)
\(2H^+ \to H_2 + 2e\\ 2H^+ + O^{2-} \to H_2O\)
Ta có : \(n_{H^+} =2n_{H_2SO_4} = 2n_{H_2} + 2n_{O(Y)}\)
\(\Rightarrow n_{O(Y)} = 0,7(mol)\)
Bảo toàn nguyên tố với O : 3a + bn = 0,7 + 0,15 = 0,85(2)
Sau phản ứng, không thu được kim loại R,chứng tỏ R không phản ứng với CO
Mà sau khi nung T thu được khối lượng oxit lớn hơn khối lượng X ban đầu. Chứng tỏ muối sunfat của kim loại R không tan trong nước.
Vậy,101,05 gam chất rắn gồm :
\(Fe(OH)_3 : 2a(mol)\\ R_2(SO_4)_n : b(mol)\)
⇒107.2a + b(2R + 96n) = 101,05(3)
Từ (1)(2)(3) suy ra a = 0,2 ; Rb = 17,125 ; bn = 0,25
Suy ra :\(R = \dfrac{17,125}{\dfrac{0,25}{n}} = \dfrac{137}{2}n\)
Với n = 2 thì R = 137(Ba) .Vậy oxit : BaO
Đúng 2
Bình luận (4)