Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa (a mol Na2SO4, b mol Al2(SO4)3). Đồ thu biểu diễn như sau. Tìm a, b. ( Làm theo phương trình hóa học giúp mình nhé!)
Bài 18. Nhôm
Tại thời điểm khối lượng 36,51 gam là lượng kết tủa lớn nhất gồm Al(OH)3, BaSO4. Còn tại thời điểm 34,95 gam là lượng kết tủa chỉ gồm có BaSO4.
PTHH: \(Na_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2NaOH\)
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaSO_4\downarrow\)
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
\(n_{BaSO_4}=\dfrac{34,95}{233}=0,15\left(mol\right)\\ n_{Al\left(OH\right)_3}=\dfrac{36,51-34,95}{78}=0,02\left(mol\right)\)
BTNT Al: \(b=n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al\left(OH\right)_3}=0,01\left(mol\right)\)
BT =SO4: \(a=n_{Na_2SO_4}=n_{BaSO_4}-3n_{Al_2\left(SO_4\right)_3}=0,12\)
Đúng 2
Bình luận (0)
Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch hỗn hợp Al2(SO4)3 và Na2SO4 ta có đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo số mol Ba(OH)2 như sau. Tìm x, t? (P/s: Làm theo phương trình giúp mình nhé!)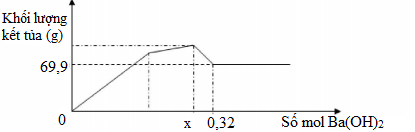
Câu hỏi nhỏ: Sục hỗn hợp khí (CO, CO2) vào dung dịch Ba(AlO2)2 thu được kết tủa H và dung dịch G. Hỏi thành phần của H, G? (P/s: Đề bài chưa nói hỗn hợp khí dư hay hết)
H : $Al(OH)_3 ; BaCO_3$(có thể có)
G : $Ba(HCO_3)_2$ (có thể có)
$Ba(AlO_2)_2 + CO_2 + 3H_2O \to 2Al(OH)_3 + BaCO_3$
$BaCO_3 + CO_2 + H_2O \to Ba(HCO_3)_2$
Đúng 2
Bình luận (0)
H : Al(OH)3;BaCO3Al(OH)3;BaCO3(có thể có)
G : Ba(HCO3)2Ba(HCO3)2 (có thể có)
Ba(AlO2)2+CO2+3H2O→2Al(OH)3+BaCO3Ba(AlO2)2+CO2+3H2O→2Al(OH)3+BaCO3
BaCO3+CO2+H2O→Ba(HCO3)2
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 16,6g hỗn hợp cùng Na và Ca vào H2O thu được 8,96l khí H2 (đktc)
a) Tính khối lượng từng kim loại trong hỗn hợp ban đầu
b)Tính khối lượng các bazơ tạo thành
a, PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Na}=x\left(mol\right)\\n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 23x + 40y = 16,6 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ca}=\dfrac{1}{2}x+y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,2.23=4,6\left(g\right)\\m_{Ca}=0,3.40=12\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{Ca\left(OH\right)_2}=n_{Ca}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,2.40=8\left(g\right)\\m_{Ca\left(OH\right)_2}=0,3.74=22,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa đồng thời HCl và Al2(SO4)3. Khối lượng kết tủa phụ thuộc vào số mol Ba(OH)2 được biểu diễn như hình sau. Tìm tổng (x+y). (Làm theo phương trình hóa học giúp mình nhé!)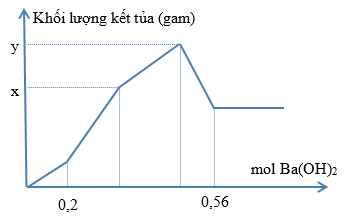
Đoạn OA :
\(Ba\left(OH\right)_2+2HCl\text{→}BaCl_2+2H_2O\)
0,2 0,2 (mol)
\(3BaCl_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2AlCl_3\)
0,2 0,6 \(\dfrac{0,4}{3}\) (mol)
Đoạn AB :
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2Al\left(OH\right)_3\)
3a 3a 2a (mol)
Đoạn BC :
\(2AlCl_3+3Ba\left(OH\right)_2\text{→}2Al\left(OH\right)_3+3BaCl_2\)
\(\dfrac{0,4}{3}\) 0,2 \(\dfrac{0,4}{3}\) (mol)
Đoạn CD :
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\text{→}Ba\left(AlO_2\right)_2+4H_2O\)
(\(\dfrac{0,4}{3}\)+2a) (\(\dfrac{0,2}{3}\) + a) (mol)
$\Rightarrow n_{Ba(OH)_2} = 0,2 + 3a + 0,2 + \dfrac{0,2}{3} + a = 0,56 \Rightarrow a = \dfrac{7}{300}$
Suy ra:
$x = 0,6.233 + 3a.233 + 2a.78 = 139,8 + 855a = 159,75(gam)$
$y = x + \dfrac{0,4}{3}.78 = 170,15(gam)$
Đúng 1
Bình luận (0)
Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch HCl (a mol) và Al2(SO4)3 (b mol). Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau. Tính giá trị của a:b? ( trình bày chi tiết giúp em theo pthh với!)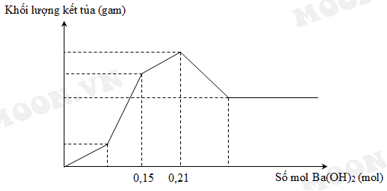
Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch H2SO4 và Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau. Tính giá trị m max. (Trình bày chi tiết giúp em theo pthh với!)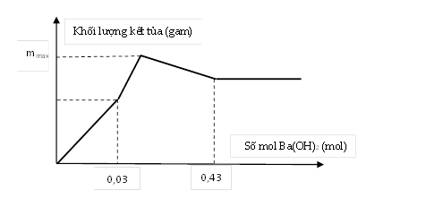
cho 5,4 g Al và 100ml dd H2SO4 0,5M . Thể tích H2 sinh ra (ở đktc) và nống độ mol của dd sau phản ứng là : ( giả sử thể tích dd thay đổi không đáng kể )
A. 1,12 lít và 0,17M B. 6,72 lít và 1,0M
C. 11,2 lít và 1,7M D . 67,2 lít và 1,7M
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) ; \(n_{H_2SO_4}=0,5.0,1=0,05\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,2 < 0,05 ( mol )
0,05 1/60 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{\dfrac{1}{60}}{0,1}=0,17\left(M\right)\)
`->` Chọn `A`
Đúng 3
Bình luận (0)
đốt cháy hoàn toàn 1,35g nhôm trong oxi . Khối lượng nhôm Oxit tạo thành và khối lượng oxi đã tham gia phản ứng là
A, 2,25g và 1,2g B . 2,55g và 1,28g
C. 2,55 và 1,2g C. 2,7 và 3,2g
\(n_{Al}=\dfrac{1,35}{27}=0,05\left(mol\right)\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,05 0,0375 0,025 ( mol )
\(m_{Al_2O_3}=0,025.102=2,55\left(g\right)\)
\(m_{O_2}=0,0375.32=1,2\left(g\right)\)
`->` Chọn `C`
Đúng 4
Bình luận (0)
Hòa tan hoàn toàn 42,4 gam hỗn hợp X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng, vừa đủ thu được dung dịch Y chỉ chứa 93,6 gam hỗn hợp hai muối sunfat trung hòa và 4,48 lit khí SO2 (sản phẩm khử duy nhất ở đktc). a. Xác định công thức phân tử của FexOy. b. Cho 42,4 gam X vào dung dịch HCl dư. Sau phản ứng còn lại m gam chất rắn không tan. Tính m. (Làm chi tiết phần b giúp em với!)
a)
Coi hỗn hợp X gồm $Fe(a\ mol) ; O(b\ mol) ; Cu(c\ mol)$
$\Rightarrow 56a + 16b + 64c = 42,4(1)$
TH1 : Nếu Y gồm muối sắt III
Sau phản ứng, Y gồm :
$Fe_2(SO_4)_3 : 0,5a(mol)$
$CuSO_4 : c(mol)$
$\Rightarrow 0,5a.400 + 160c = 93,6(2)$
$n_{SO_2} = 0,2(mol)$
Bảo toàn electron: $3n_{Fe} + 2n_{Cu} = 2n_O + 2n_{SO_2}$
$\Rightarrow 3a + 2c = 2b + 0,2.2(3)$
Từ (1)(2)(3) suy ra a = 0,06 ; b = 0,4 ; c = 0,51
$n_{Fe} : n_O = 0,06 : 0,4 = 3 : 20$ (loại)
TH2 : Nếu Y gồm muối sắt II
Y gồm :
$FeSO_4 : a(mol)$
$CuSO_4 : c(mol)$
$\Rightarrow 152a + 160c = 93,6(4)$
Bảo toàn electron : $2n_{Fe} + 2n_{Cu} = 2n_O + 2n_{SO_2}$
$\Rightarrow 2a + 2c = 2b + 0,2.2(5)$
Từ (1)(4)(5) suy ra a = 0,3 ; b = 0,4 ; c = 0,3
Ta có $n_{Fe} : n_O = 0,3 : 0,4$ Vậy oxit là $Fe_3O_4$
b) $n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = 0,1(mol)$
\(Fe_3O_4+8HCl\text{→}2FeCl_3+FeCl_2+4H_2O\)
0,1 0,2 (mol)
\(2FeCl_3+Cu\text{→}CuCl_2+2FeCl_2\)
0,2 0,1 (mol)
$\Rightarrow n_{Cu\ dư} = 0,3 - 0,1 = 0,2(mol)$
$m = 0,2.64 = 12,8(gam)$
Đúng 2
Bình luận (0)




