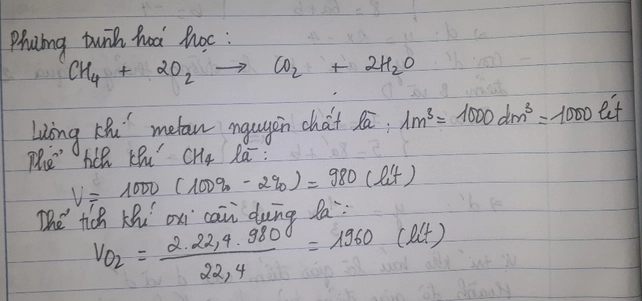Viết phương trình chữ của phản ứng trên. Biết vỏ quả trứng (thành phần chủ yếu là calcium carbonate) đã phản ứng với hydrochloric acid tạo calcium choloride .nước và khí carbonate dioxide cho biete cu=64;fe=56;ca=40;n=14;s=32;o=16;k=39;ci=35,5
Bài 14: Bài thực hành 3
Cho m gam Ba(OH)2 tác dụng vừa đủ với 200g dd HCl 7,3% thu được muối và nước. Tính khối lượng Ba(OH)2 đã tham gia phản ứng?
\(n_{HCl}=\dfrac{200\cdot7.3\%}{36.5}=0.4\left(mol\right)\)
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
\(0.2..................0.4\)
\(m_{Ba\left(OH\right)_2}=0.2\cdot171=34.2\left(g\right)\)
Đúng 0
Bình luận (2)
Biết nguyên tử B có tổng số hạt là 21. Số hạt không mang điện chiếm 33.33%. Xác định số hạt mang điện.
7
14
5
21
Theo bài ta có :\(2p+n=21\left(p=e\right)\)
Mặt khác: số hạt không mang điện chiếm 33.33%
=> \(n=33,33\%.21\approx7\)
\(\Rightarrow p=e=\dfrac{21-7}{2}=7\)
Vậy số hạt mang điện là 14
Đúng 1
Bình luận (0)
N= 33,33%.21=7(hạt)
Số hạt mang điện: 21-7=14(hạt)
=>CHỌN 14
Đúng 2
Bình luận (0)
Bài 2 :
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ C + O_2 \xrightarrow{t^o} CO_2\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ \)
Đúng 1
Bình luận (0)
Bài 3 :
\(a) 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ b) n_{Al} = \dfrac{10,8}{27}=0,4(mol)\\ n_{H_2} = \dfrac{3}{2}n_{H_2} = 0,6(mol)\\ V_{H_2} = 0,6.22,4 = 13,44(lít)\\ c) Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe} = \dfrac{3}{4}n_{H_2} =0,45(mol)\\ m_{Fe} = 0,45.56 = 25,2(gam)\)
Đúng 1
Bình luận (0)
Bài 4 :
\(a) 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ b) n_{KMnO_4} =\dfrac{18,96}{158}=0,12(mol)\\ n_{O_2}= \dfrac{1}{2}n_{KMnO_4} =0,06(mol)\\ V_{O_2} = 0,06.22,4= 1,344(lít)\\ c) n_{Al} = \dfrac{1,62}{27} = 0,06(mol)\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ \dfrac{n_{Al}}{4} = 0,015 < \dfrac{n_{O_2}}{3} = 0,02 \to O_2\ dư\\ n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,03(mol)\\ \)
\(m_{Al_2O_3} = 0,03.102 = 3,06(gam)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 6 g C trong bình kín đựng 22,4 lít khí O2, sau phản ứng thể tích khí trong bình là (các thể tích được đo ở đktc)
PTHH: C + \(O_2\) ---> \(CO_2\)
0,5 mol 0,5 mol 0,5 mol
+ Số mol của C:
\(n_C\) = \(\dfrac{m}{M}\) = \(\dfrac{6}{12}\) = 0,5 (mol)
+ Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{22,4}{22,4}\) = 1 (mol)
Tỉ lệ: C \(O_2\)
0,5 < 1
=> C hết; \(O_2\) dư
+ Thể tích \(CO_2\)
\(V_{O_2}\) = n . 22,4 = 0,5 . 22,4 = 11,2 (lít)
Vậy: thể tích khí \(CO_2\) sau phản ứng là 11,2 lít
Đúng 2
Bình luận (0)
\(n_C=\dfrac{6}{12}=0,5\left(mol\right)\)
\(n_{O_2}=\dfrac{22,4}{22,4}=1mol\)
pt : \(C+O_2\rightarrow CO_2\)
Theo pt \(\dfrac{n_C}{n_{O_2}}=0,5:1=1:2\)
=> Oxi dư
\(n_{O_2}\) dư = 1 - 0,5 = 0,5 (mol)
=> \(V_{O_2}dư=11,2lit\)
Theo pt : \(n_{CO_2}=0,5\left(mol\right)\)
=> VCO2 = 11,2 lít
Vậy trong bình còn lại 11,2 lí CO2 và 11,2 lít O2
Đúng 1
Bình luận (0)
Hòa tan thuốc tím vào nước thì không nhìn thấy thuốc tím được nữa vì sao
Xem chi tiết
Thuốc tím có công thức hóa học là KMnO4.Nghiền nhỏ KMnO4 ở dạng rắn rồi hòa vào nước. Do tính tan trong nước nên KMnO4 sẽ chuyển từ thể rắn sang thể lỏng. Do đó, ta không nhìn thấy thuốc tím ở dạng rắn nữa.
Đúng 1
Bình luận (0)
Biết nguyên tử B có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác định cấu tạo của nguyên tử B.
Số hạt không mang điện chiếm 33,33% nghĩa là % n = 33,33; tổng số hạt là 21, tức X = 21. Tìm p, e.
% n = 33,33% ⇒⇒ n = 33,33.2110033,33.21100 = 7 (1)
X = p + n + e mà p = e ⇒⇒ 2p + n = 21 (2)
Thế (1) vào (2) ⇒⇒ p = e = 21−7221−72 = 7
Vậy nguyên tử B có điện tích hạt nhân 7+ , có 7e
Đúng 3
Bình luận (0)
Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử nhôm, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hãy cho biết số khối của nhôm.
Ta có điện tích hạt nhân là 13+ , tức p = 13 (1)
Ta lại có (p+e) – n = 12
Mà p = e Suy ra 2 p – n = 12 (2)
Thế (1) vào (2) ta được: 2 . 13 – n = 12
Suy ra n = 26 - 12 = 14
Số khối A = p + n = 13 + 14 = 27. Vậy số khối của nhôm là 27.
Đúng 0
Bình luận (0)
có nguyê tử nhôm có điện tích hạt nhân là 13+nên p=13
vì số hạt mang điện nhiều hơn số hạt ko mang điện là 12
<=> (p+e)-n=12
mà trong mọi nguyên tử luôn có p=e
nên 2p-n=12
có p=13 nên
2\(\times\)13-n=12
26-n=12
n=26-12
n=14
số khối của nhôm sẽ là 13+14=27
Đúng 0
Bình luận (0)
Hòa tan 8,7 gam một hỗn hợp gồm Kali và một kim loại M (hóa trị II) trong dung
dịch HCl dư thì thu được 5,6 lít khí H 2 (đktc). Hòa tan riêng 9 gam kim loại M trong dung dịch HCl dư thì
thể tích khí H 2 sinh ra chưa đến 11 lít khí H 2 (đktc). Hãy xác định kim loại M
Gọi số mol K, M trong hỗn hợp lần lượt là a, b (mol)
PTHH:
2K + 2H2O ===> 2KOH + H2 \(\uparrow\)
a...................................a.............0,5a
KOH + HCl ===> KCl + H2O
M + 2HCl ===> MCl2 + H2 ↑
b............................................b
Theo đề ra, ta có hệ: \(\left\{{}\begin{matrix}39a+Mb=8,7\\0,5a+b=0,25\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}M=\dfrac{8,7-39a}{b}\\0,5a+b=0,25\end{matrix}\right.\)
\(\Leftrightarrow M=\dfrac{8,7-39a}{0,25-0,5a}\)
\(\Rightarrow M< ....\) (tự làm) (1)
Mặt khác, htan riêng 9 gam kim loại M trong dung dịch HCl dư thì thể tích H2 sinh ra chưa đến 11 lít
PTHH:
M + 2HCl ==> MCl2 + H2
\(\dfrac{9}{M}\) .................................\(\dfrac{9}{M}\)
Theo để, suy ra \(\dfrac{9}{M}< \dfrac{11}{22,4}\approx0,5\)
=> M > 18 (2)
Từ (1), (2) sẽ suy ra MM
Từ đó suy ra M
Đúng 0
Bình luận (0)
Để đốt cháy hết 1.6g hợp chất Y cần dùng 1.2.10^23 phân tử oxi, thu được khí CO2 và hơi nước theo tỉ số mol là 1:2
a)Tìm khối lượng khí CO2 và hơi nước tạo thành
b)Tìm CTPT của Y biết tỉ khối của Y đối với H2=8
nO2= 0,2 mol.
m O2= 6,4 gam
=> tổng m H2O + CO2= 1,6 + 6,4= 8 gam .
gọi a là nCO2 => 2a là nH2O. ta có :
44a + 36a= 8 => a= 0,1 mol
=> mCO2= 4,4 gam
=>mH2O= 3,6 gam
b. nCO2= 0,1 mol => nC= 0,1 mol
nH2O= 0.2 mol => nH= 0,4 mol
nC:nH= 1:4 =>CTPT có dạng (CH4)n.
vì M_Y= 16 <=> 16n=>n=1. => CTPT của Y là CH4.
Đúng 0
Bình luận (0)