Một nhà máy phát điện vận hành bằng các đốt cháy nhiên liệu phức hợp có công thức trung bình là C11H7S. Giả sử nguồn không khí cung cấp chỉ chứa N2 và O2 có tỷ lệ mol 3,76:1,00 và N2 không cho phản ứng. Ngoài nước tạo thành, lượng cacbon trong nhiên liệu được chuyển hóa hoàn toàn thành CO2 và lưu huỳnh chuyển hóa thành SO2.
(a) Viết phương trình phản ứng cháy của C11H7S.
(b) Để phản ứng cháy xảy ra hoàn toàn, thực tế cần dùng dư 20% lượng oxy so với tỷ lượng lý thuyết. Tính khối lượng (kg) và thể tích (ở đktc, m3) không khí cần sử dụng để đốt cháy hoàn toàn 1 tấn C11H7S.
(c) Tính tổng khối lượng CO2 và SO2 tạo thành trong điều kiện của câu (b) trên

Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
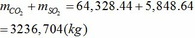
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

