Một hỗn hợp 4,15g chứa Fe và Al tác dụng với 200ml dung dịch C u S O 4 0,525M. Khuấy kỹ để phản ứng xảy ra hoàn toàn. Thu được kết tủa gồm hai kim loại có khối lượng 7,84g. Tìm số mol các kim loại trong hỗn hợp ban đầu.
A. 0,25 mol và 0,75 mol
B. 0,75 mol và 0,25 mol
C. 0,05 mol và 0,05 mol
D. Đáp án khác
n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
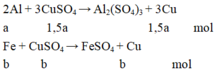
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

