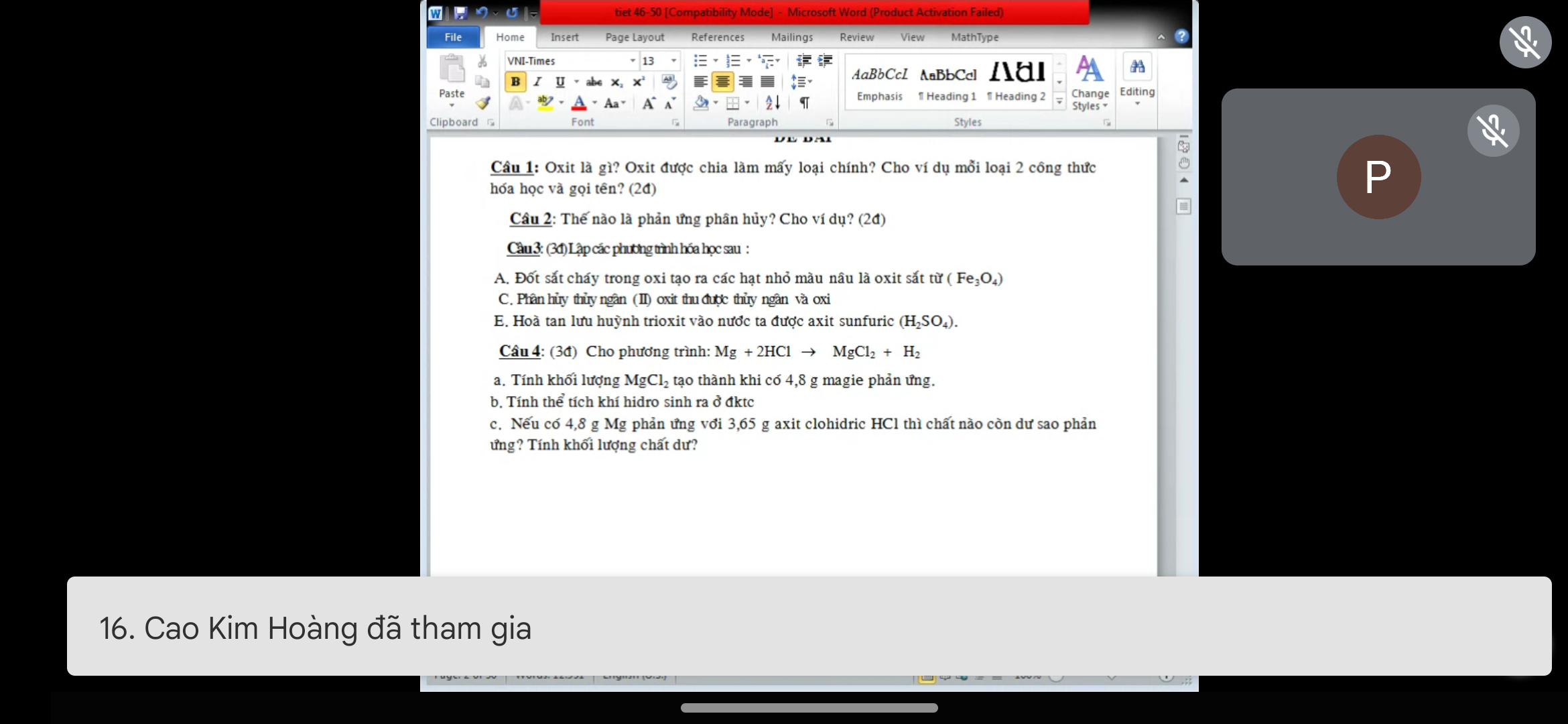
\(n_{Mg}=\dfrac{4,8}{24}=0,2mol\)
a)\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{MgCl_2}=0,2\cdot95=19g\)
b)\(V_{H_2}=0,2\cdot22,4=4,48l\)
c)\(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
Sau phản ứng Mg còn dư và dư 0,15mol
\(m_{Mgdư}=0,15\cdot24=3,6g\)