Số mol của sắt (III) oxit
nFe2O3= \(\dfrac{m_{Fe2O3}}{M_{Fe2O3}}=\dfrac{8}{160}=0,05\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4= \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{6.306,25}{100}=18,375\) (g)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{18,375}{98}=0,1875\left(mol\right)\)
Pt : Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O\(|\)
1 3 1 3
0,05 0,1875 0,0625
a) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,1875}{3}\)
⇒ Fe2O3 phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Fe2O3
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 0,1875 - \(\left(\dfrac{0,05.3}{1}\right)\)
= 0,0375 (mol)
Khối lượng dư của dung dịch axit sunfuric
mdư= ndư. MH2SO4
= 0,0375 . 98
= 3,675 (g)
Số mol của sắt (III) sunfat
nFe2(SO4)3 = \(\dfrac{0,1875.1}{3}=0,0625\left(mol\right)\)
Khối lượng của sắt (III) sunfat
mFe2(SO4)3 = nFe2(SO4)3 . MFe2(SO4)3
= 0,0625 .400
= 25 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe2O3 + mH2SO4
= 8 + 306,25
= 314,25 (g)
Nồng độ phần trăm của sắt (III) oxit
C0/0Fe2(SO4)3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{25.100}{314,25}=7,96\)0/0
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{3,675.100}{314,25}=0,33\)0/0
Chúc bạn học tốt
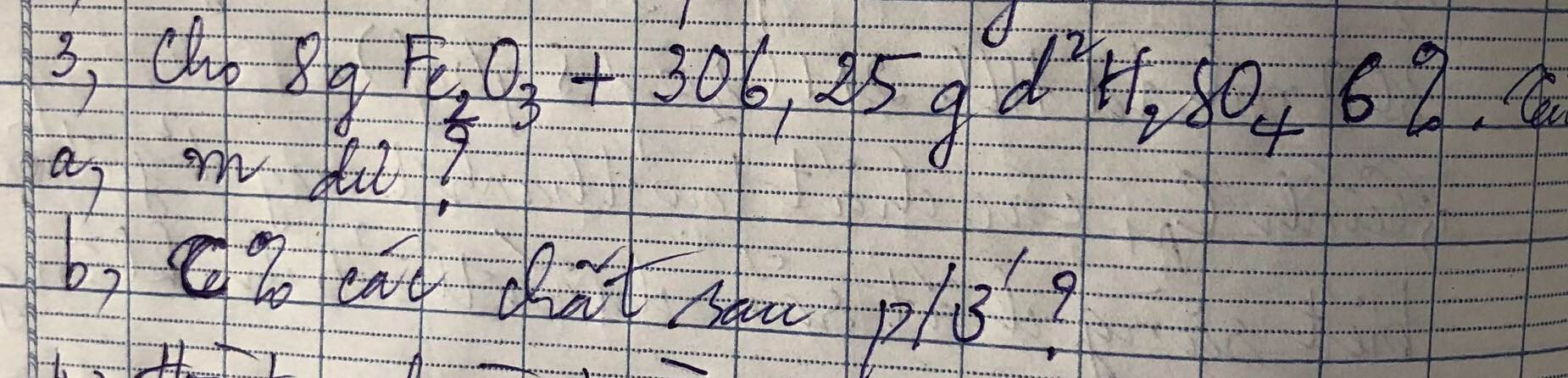








 giúp mình với mình cần gấp ạ
giúp mình với mình cần gấp ạ