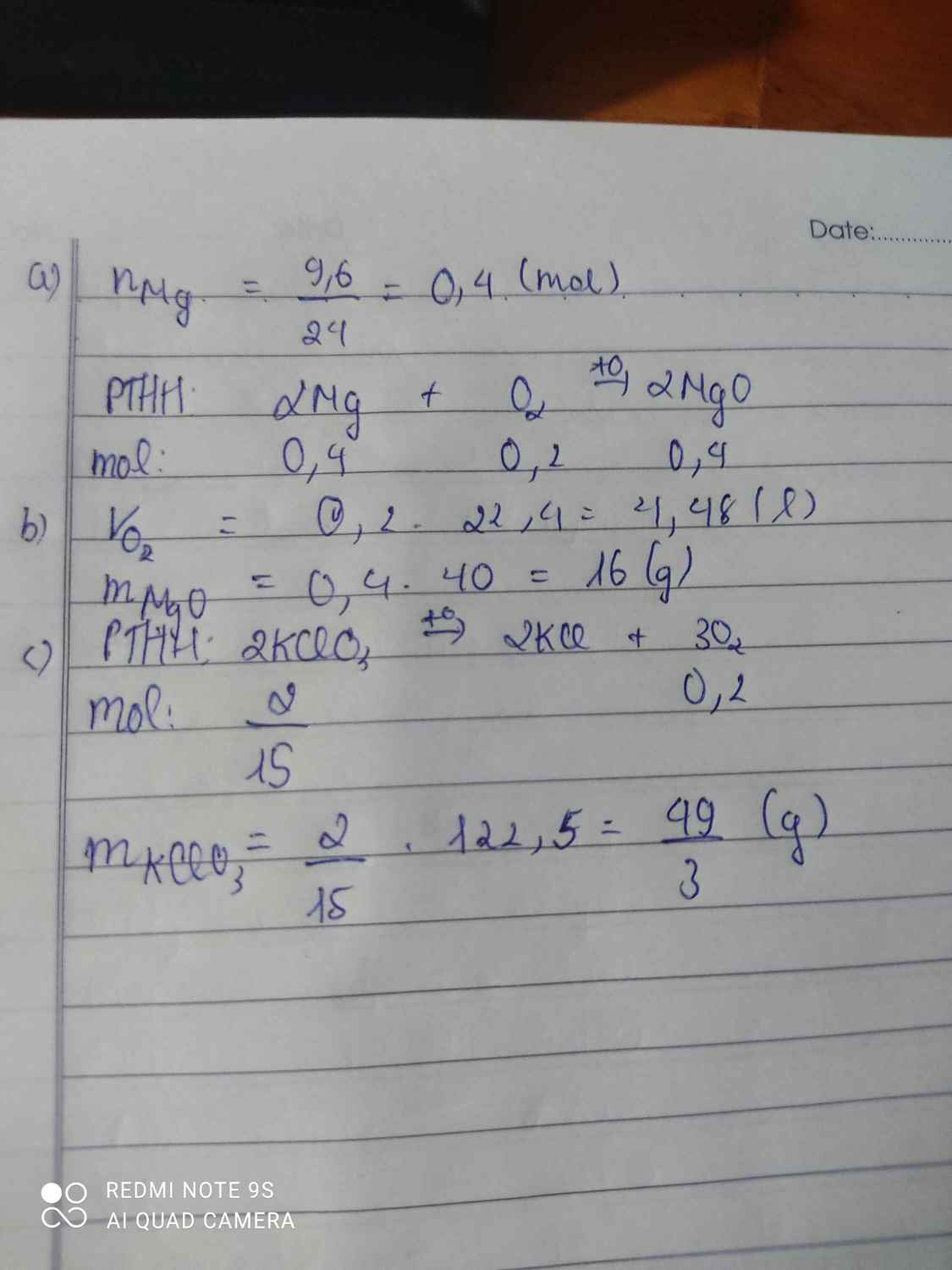\(a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ b,n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right)\\ n_{MgO}=n_{Mg}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ b,x=m_{MgO}=40.0,4=16\left(g\right)\\ V=V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ c,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\uparrow\\ n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
a, 2Mg + O2 \(\rightarrow\) 2MgO (bạn thêm to trên cái mũi tên nhé)
b, nMg = \(\dfrac{9,6}{24}\) = 0,4 (mol)
PTPƯ: 2Mg + O2 \(\rightarrow\) 2MgO
2g/mol 1g/mol 2g/mol
\(\Rightarrow\) 0,4 0,2 0,4
VO2 = 0,2 . 22,4 = 4,48l
mMgO = 0,4 . (24 + 16) = 16(g)