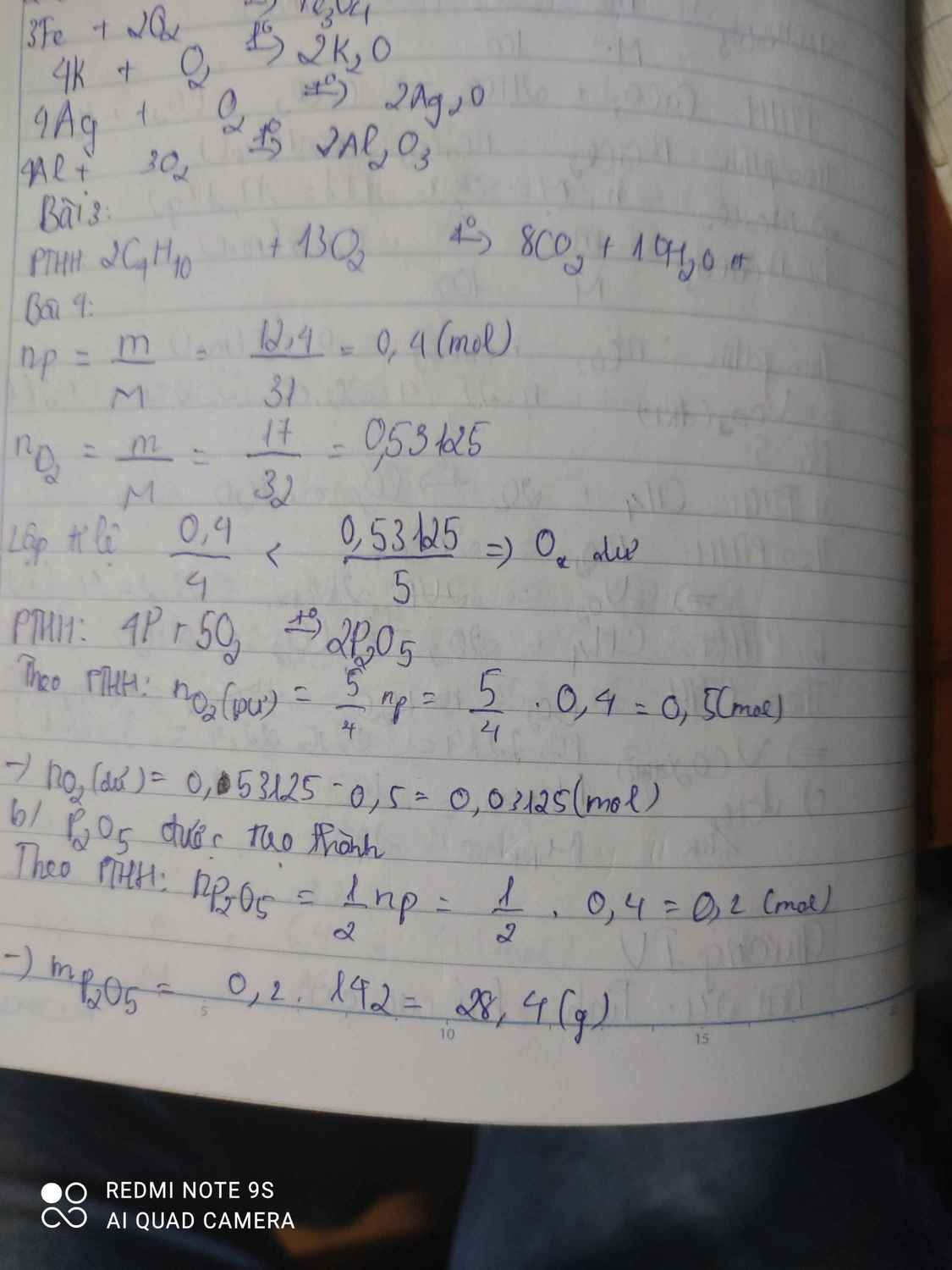\(n_P=\dfrac{m_p}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,4 0,53125 ( mol )
ta có: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\)
=> Chất dư là \(O_2\)
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là \(P_2O_5\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=\left(\dfrac{0,4.2}{4}\right).142=28,4g\)