Lắp ráp mô hình phân tử CH≡CH, biết toàn bộ các nguyên tử nằm trên cùng một đường thẳng.
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
Bài 10: Liên kết cộng hoá trị
H24
Hướng dẫn giải
Thảo luận (1)
H24
Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Hướng dẫn giải
Thảo luận (1)
Bài 1: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Trả lời bởi Trịnh Long
H24
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Hướng dẫn giải
Thảo luận (1)
- Xét phân tử H2S được tạo từ 2 phi kim
+ S có 6 electron ở lớp ngoài cùng
+ H có 1 eelctron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và S cần thêm 2 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 2 nguyên tử H và 1 nguyên tử S liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử S góp ra 2 electron để tạo ra 2 đôi electron dùng chung
- Xét phân tử PH3 được tạo từ 2 phi kim
+ P có 5 electron ở lớp ngoài cùng
+ H có 1 elctron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và P cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử P liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử P góp ra 3 electron để tạo ra 3 đôi electron dùng chung
Trả lời bởi Trịnh Long
H24
Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4.
Hướng dẫn giải
Thảo luận (1)
- Phân tử CS2: Mỗi nguyên tử S sẽ góp 2 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung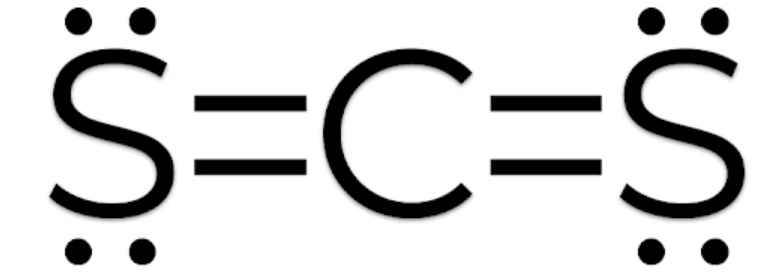
- Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử S góp 2 electron để tạo thành 2 cặp electron dùng chung
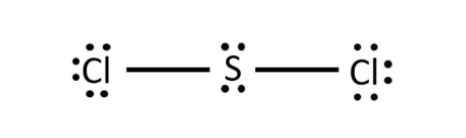
- Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung
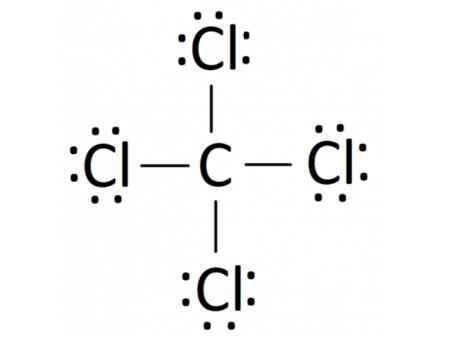
H24
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2)
Hướng dẫn giải
Thảo luận (1)
- O có 6 electron ở lớp ngoài cùng => Cần nhận thêm 2 electron
- S có 6 elctron ở lớp ngoài cùng => Cần nhận thêm 2 electron
=> 1 nguyên tử S sẽ liên kết với 1 nguyên tử O bằng cách góp chung 2 electron
- Khi đó nguyên tử S có 8 electron, O có 8 electron ở lớp ngoài cùng => Còn 1 O chưa tham gia liên kết
- Trong khi đó nguyên tử S vẫn còn 2 đôi electron chưa tham gia liên kết
=> Nguyên tử S sẽ cho nguyên tử O chưa tham gia liên kết 1 cặp electron để dùng chung
=> Công thức electron và công thức cấu tạo:

H24
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Hướng dẫn giải
Thảo luận (1)
Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
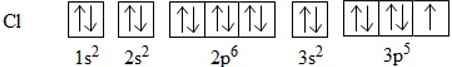
Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử chlorine
Trả lời bởi Mai Trung Hải Phong
H24
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết п? Cho ví dụ.
Hướng dẫn giải
Thảo luận (1)
H24
Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Hướng dẫn giải
Thảo luận (1)
H24
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau: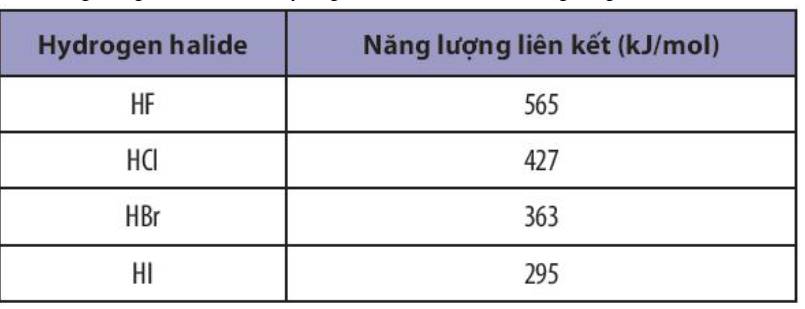
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI.
Hướng dẫn giải
Thảo luận (1)
- Sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF
=> Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF
Trả lời bởi Mai Trung Hải Phong

Trả lời bởi Mai Trung Hải Phong