Bài 1: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Bài 1: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Em có nhận xét gì khi cặp electron chung trong liên kết lệch hẳn về một phía nguyên tử?
Trong các phân tử HCl, NH3 và CO2, cặp electron chung lệch về phía nguyên tử nào? Giải thích.
Biết phân tử CO cũng có liên kết cho – nhận. Viết công thức electron và công thức cấu tạo của CO.
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Nêu thêm ví dụ về phân tử có liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực. Viết công thức electron của chúng để minh họa.
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Quan sát các Hình từ 10.5 đến 10.8, cho biết liên kết nào trong mỗi phân tử được tạo thành bởi sự xen phủ trục hoặc xen phủ bên của các orbital.
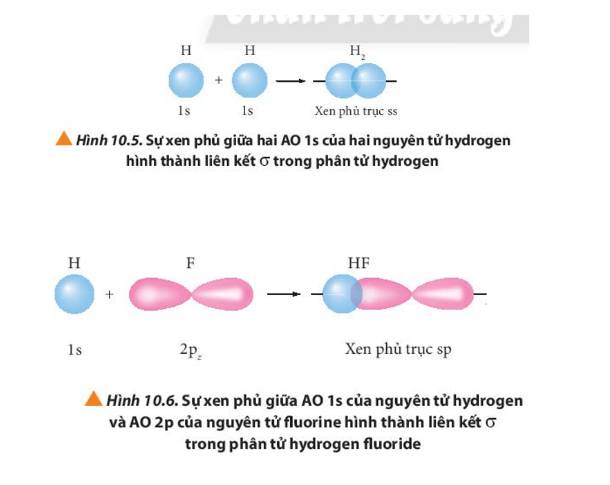
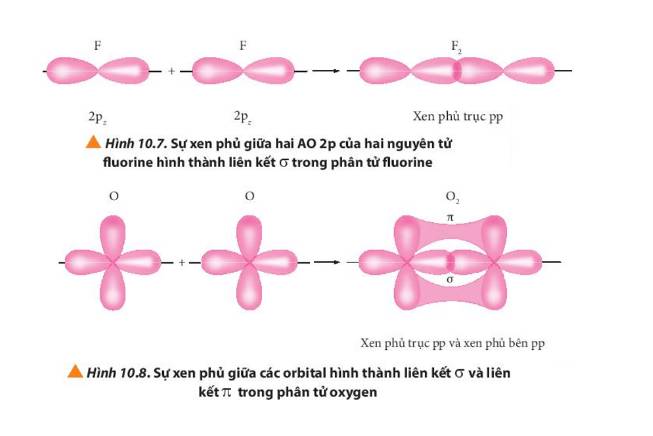
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Cho biết đặc điểm của nguyên tử “cho” và nguyên tử “nhận” trong phân tử có liên kết cho – nhận.