Trong các phân tử HCl, NH3 và CO2, cặp electron chung lệch về phía nguyên tử nào? Giải thích.
Bài 10: Liên kết cộng hoá trị
H24
Hướng dẫn giải
Thảo luận (1)
H24
Theo em vì sao năng lượng liên kết luôn có giá trị dương?
Hướng dẫn giải
Thảo luận (1)
Năng lượng liên kết luôn có giá trị dương vì để phá vỡ các liên kết giữa các nguyên tử thì cần phải cung cấp năng lượng.
Trả lời bởi Trịnh Long
H24
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Hướng dẫn giải
Thảo luận (1)
- Công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4 lần lượt là: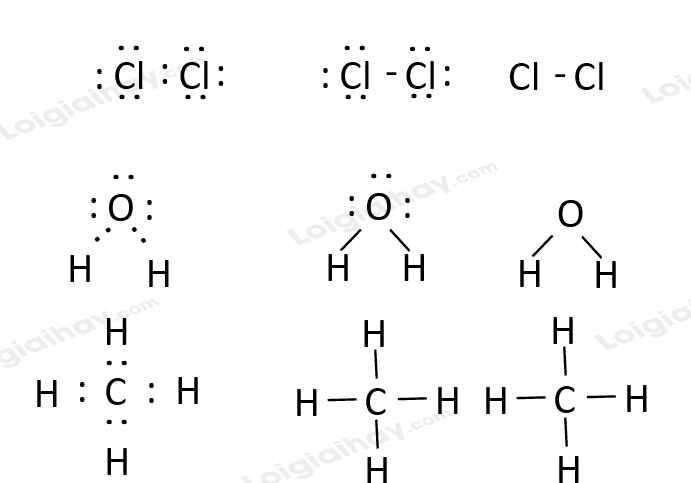
H24
Trong một số trường hợp đặc biệt, khí nitrogen được sử dụng để bơm lốp (vỏ) xe thay cho không khí là do khí oxygen có trong không khí có thể oxi hóa cao su theo thời gian. Khí nitrogen vì sao khắc phục được nhược điểm này?
Hướng dẫn giải
Thảo luận (1)
- Để phá vỡ 1 mol phân tử N2 cần cùng cấp năng lượng lớn là 945 kJ
=> Phân tử N2 rất khó bị phá vỡ, bền ở điều kiện thường
=> Nitrogen không tham gia phản ứng hóa học ở điều kiện thường
=> Nitrogen sẽ không oxi hóa cao su
=> Người ta dùng khí nitrogen để bơm vào lốp xe, tránh mòn lốp
Trả lời bởi Mai Trung Hải Phong
H24
Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị phân cực hay không phân cực? Giải thích.
Hướng dẫn giải
Thảo luận (1)
- Phân tử dạng A2 được tạo bởi 2 nguyên tử giống nhau
=> Hiệu độ âm điện = 0
=> Cộng hóa trị không phân cực
=> Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị không phân cực
Trả lời bởi Mai Trung Hải Phong
H24
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Đọc tiếp
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Hướng dẫn giải
Thảo luận (1)
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị.
Trả lời bởi Mai Trung Hải Phong
H24
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2.
Hướng dẫn giải
Thảo luận (1)
- Xét phân tử HCl:
+ Nguyên tử H có 1 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron
=> Nguyên tử H và Cl sẽ góp 1 electron tạo thành 1 cặp electron chung
- Xét phân tử O2:
+ Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron
=> Mỗi nguyên tử O sẽ góp 2 electron tạo thành 2 cặp electron chung
- Xét phân tử N2:
+ Nguyên tử N có 5 electron ở lớp ngoài cùng, có xu hướng nhận thêm 3 electron
=> Mỗi nguyên tử N sẽ góp 3 electron tạo thành 3 cặp electron chung
Trả lời bởi Mai Trung Hải Phong
H24
Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3.
Hướng dẫn giải
Thảo luận (1)
- Xét phân tử khí amonia
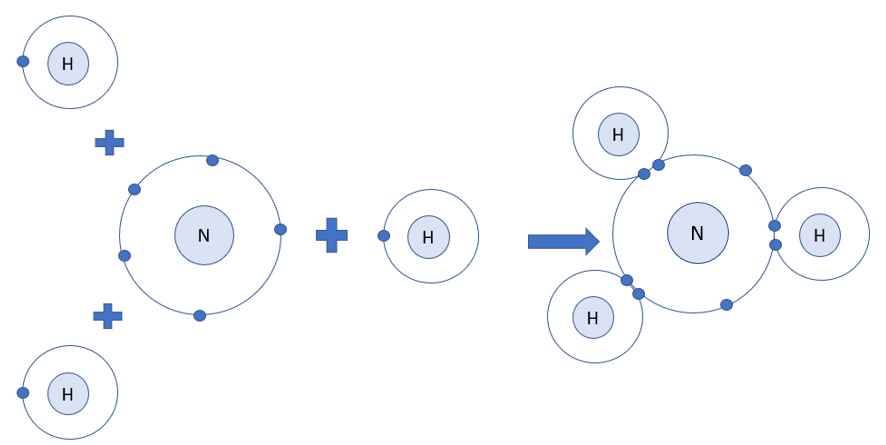
- Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
Trả lời bởi Mai Trung Hải Phong
H24
Em có nhận xét gì khi cặp electron chung trong liên kết lệch hẳn về một phía nguyên tử?
Hướng dẫn giải
Thảo luận (1)
- Trong liên kết cộng hóa trị phân cực, cặp electron chung trong liên kết lệch hẳn về phía nguyên tử có độ âm điện lớn hơn
=> Nguyên tử có độ âm điện lớn hơn sẽ mang số oxi hóa âm, nguyên tử có độ âm điện nhỏ hơn sẽ mang số oxi hóa dương
- Ví dụ:
+ NH3: N có độ âm điện lớn hơn H => N trong NH3 có số oxi hóa = -3, H trong NH3 có số oxi hóa = +1
+ HCl: Cl có độ âm điện lớn H => Cl trong HCl có số oxi hóa = -1, H trong HCl có số oxi = +1
Trả lời bởi GV Nguyễn Trần Thành Đạt
H24
Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?
Hướng dẫn giải
Thảo luận (1)
- Trong phân tử HCl, Cl có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử Cl
- Trong phân tử NH3, N có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử N
- Trong phân tử CO2, O có độ âm điện lớn hơn C => Cặp electron chung lệch về phía nguyên tử O
Trả lời bởi Mai Trung Hải Phong