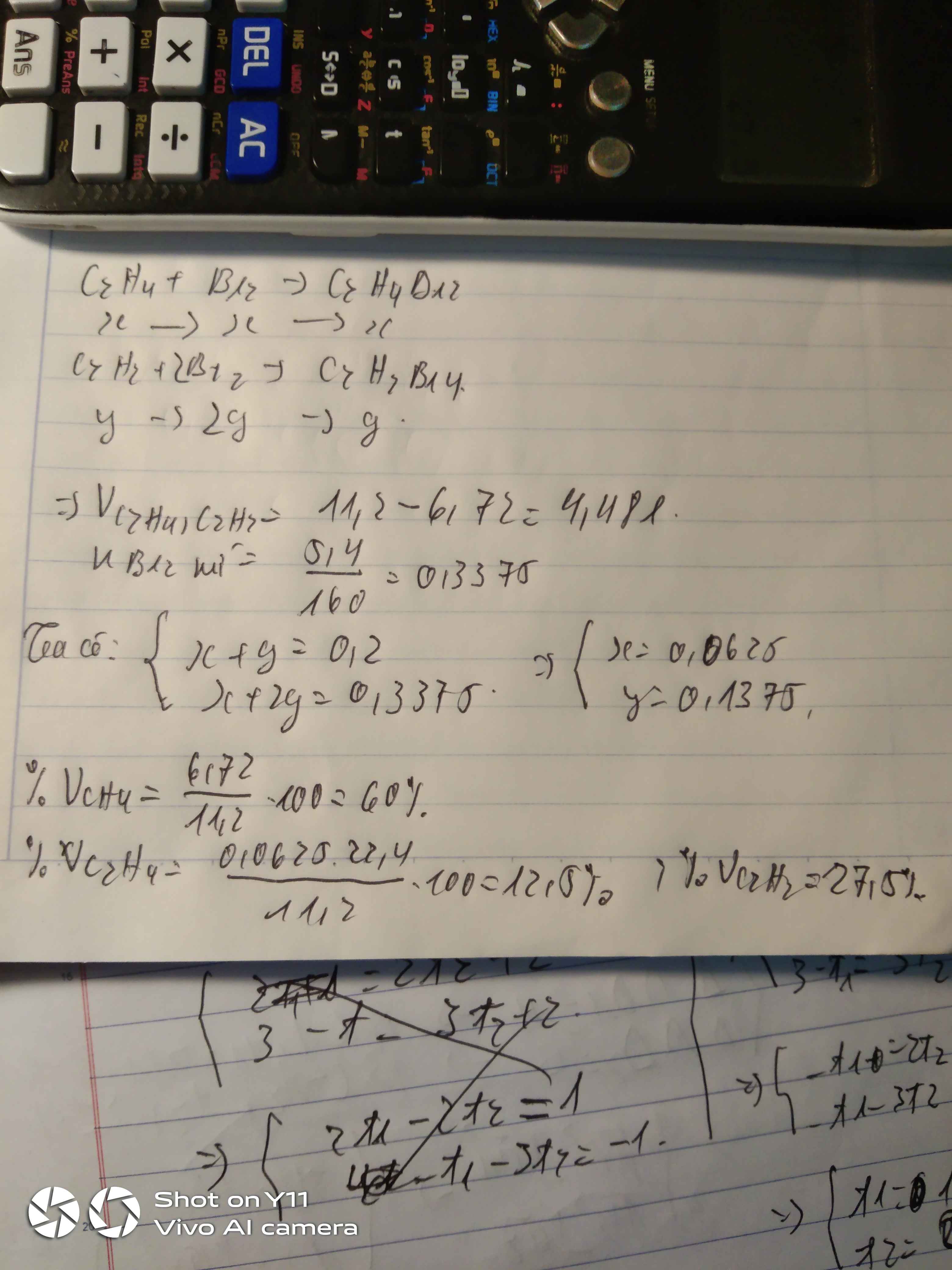Đốt cháy 28 ml hỗn hợp khí C2H4, H2 trong khí oxi vừa đủ thì thu đc 44,8ml khí CO2. a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp. b) Tính thể tích khí CO2 sinh ra. (Các thể tích khí đo ở cùng điểu kiện nhiệt độ và áp suất).
Bài 38. Axetilen
PTHH:
C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Theo pt: nC2H4 = 1/2 nCO2
=> VC2H4 = 1/2 VCO2 = 1/2 . 44,8 = 22,4 (ml)
%VC2H4 = 22,4/28 = 80%
%VH2 = 100% - 80% = 20%
Đúng 1
Bình luận (0)
Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư,
lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của mỗi khí
trong hỗn hợp ban đầu lần lượt là (chương 4/ bài 38/ mức 3)
A. 20%; 80%. B. 30%; 70%.
C .40% ; 60%. D. 60%; 40%.
\(n_{Br_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,0175<-0,035
=> \(\%V_{C_2H_2}=\dfrac{0,0175.22,4}{0,56}.100\%=70\%\)
=> %VCH4 = 100% - 70% = 30%
=> B
Đúng 1
Bình luận (0)
C2H2+2Br2->C2H2Br2
0,0175---0,035
n Br2=\(\dfrac{5,6}{160}\)=0,035 mol
=>%VC2H2=\(\dfrac{0,0175.22,4}{0,56}.100\)=70%
=>%VCH4=100-70=30%
B
Đúng 0
Bình luận (0)
Đốt cháy 1m3 khí C2H2 thì cần bao nhiêu m3 không khí. Biết rằng oxi chiếm 20 phần trăm thể tích
\(n_{C_2H_2}=\dfrac{1000}{22,4}=\dfrac{625}{14}mol\)
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
\(\dfrac{625}{14}\) \(\dfrac{3125}{28}\) ( mol )
\(V_{kk}=V_{O_2}.5=\left(\dfrac{3125}{28}.22,4\right).5=12500l=12,5m^3\)
Đúng 1
Bình luận (0)
Nêu tính chất hóa học của metan CH4 c 2 H 4 và Axetilen c 2 H 2
Dẫn 42(g) hỗn hợp khí A gồm khí metan và khí axetilen qua dung dịch Brom dư. Sau khi pứ kết thúc thấy khối lượng bình Brom tăng 36(g) a. Viết PTHH b. Tính thể tích mỗi khí trong hỗn hợp c. Tính phần trăm thể tích mỗi khí trong hỗn hợp. Biết các khí đó ở điều kiện tiêu chuẩn
a)
PTHH: C2H2+2Br2 --> C2H2Br4
b) \(n_{C_2H_2}=\dfrac{36}{26}=\dfrac{18}{13}\left(mol\right)\)
=> \(V_{C_2H_2}=\dfrac{18}{13}.22,4=\dfrac{2016}{65}\left(l\right)\)
\(n_{CH_4}=\dfrac{42-36}{16}=0,375\left(mol\right)\)
=> \(V_{CH_4}=0,375.22,4=8,4\left(l\right)\)
c) \(\left\{{}\begin{matrix}\%V_{C_2H_2}=\dfrac{\dfrac{2016}{65}}{\dfrac{2016}{65}+8,4}.100\%=78,69\%\\\%V_{CH_4}=\dfrac{8,4}{\dfrac{2016}{65}+8,4}.100\%=21,31\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 11,6(g) một hiđrocacbon A thu được 18(g) H2O a. Xác định CTPT của A biết tỉ khối của A so với hiđro = 29 b. Viết CTPT đầy đủ , thu gọn của A
\(n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\)
=> nH = 2 (mol)
mC = 11,6 - 1.2 = 9,6 (g)
=> \(n_C=\dfrac{9,6}{12}=0,8\left(mol\right)\)
Xét nC : nH = 0,8 : 2 = 2 : 5
=> CTPT: (C2H5)n
Mà MA = 29.2 = 58 (g/mol)
=> n = 2
=> CTPT: C4H10
Đúng 6
Bình luận (0)
M(A) = 29 . 2 = 58 (g/mol)
nH = 2 . nH2O = 2 . 18/18 = 2 (mol)
nC = (11,6 - 2)/12 = 0,8 (mol)
CTPT: CxHy
=> x : y = 0,8 : 2 = 2 : 5
=> (C2H5)n = 58
=> n = 2
=> CTPT: C4H10
CTTG: C2H5
Đúng 4
Bình luận (0)
Đốt cháy 5,2 gam khí C2H2 ở đktc thu được a gam khí CO2
a. Tính a
b. Sục khí sinh ra vào nước vôi trong tính khối lượng kết tủa thu được.
đốt cháy 1,12 lít khí axitilen(đktc)
a) tính khối lượng CO2 thu được sau phản ứng
b) tính thể tích không khí cần dùng biết thể tích Oxi chiếm 20% thể tích không khí
C2H2+\(\dfrac{5}{2}\)O2-to>2CO2+H2O
0,05--0,125---------0,1 mol
n C2H2=\(\dfrac{1,12}{22,4}\)=0,05 mol
=>m CO2=0,1.44=4,4g
=>Vkk=0,125.5.22,4=5,6l
Đúng 4
Bình luận (0)
Dẫn 11,2 lít (đktc) hỗn hợp khí gồm CH4, C2H4, C2H2 qua bình đựng nước brom dư thấy có 6,72 lít (đktc) khí thoát ra khỏi bình, đồng thời khối lượng bình tăng 5,4 gam. Tính % thể tích các chất trong X?
hoàn thành chuỗi phản ứng CH4---> C2H2--->C2H6--->C2H5Cl; CO2--->Ca(OH)2
hoàn thành chuỗi phản ứng
CH4---> C2H2--->C2H6--->C2H5Cl;
2CH4-1500độ\làm lạnh->C2H2+H2
C2H2+2H2-to>C2H6
C2H6+Cl2-to>C2H5Cl+HCl
CO2--->Ca(OH)2
=>Ko có pứ
Đúng 2
Bình luận (0)
2CH4 -> (làm lạnh) C2H2 + 3H2
C2H2 + 2H2 -> C2H6
C2H6 + Cl2 -> C2H5Cl + HCl
CO2 không thể ra Ca(OH)2 được
Đúng 0
Bình luận (1)