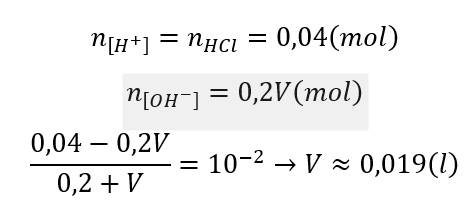1 dung dịch có nồng độ ion OH- = 0,001 m cho biết dung dịch trên là acid base hay trung tính, màu của quỳ tím trong dung dịch
Bài 3: Sự điện li của H2O - pH - Chất chỉ thị axit-bazo
\(\left[OH^-\right]=0,001M\\ \Rightarrow pH=14-pOH=14+log\left[OH^-\right]=14+log\left[0,001\right]=14-3=11\)
Đúng 2
Bình luận (3)
Cho 40 ml dung dịch HCl 0,75M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được
Ta có: \(n_{H^+}=n_{HCl}=0,04.0,75=0,03\left(mol\right)\)
\(n_{OH^-}=2n_{Ba\left(OH\right)_2}+n_{KOH}=2.0,16.0,08+0,16.0,04=0,032\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
____0,03______0,03 (mol)
\(\Rightarrow n_{OH^-\left(dư\right)}=0,032-0,03=0,002\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,002}{0,04+0,16}=0,01\left(M\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{10^{-14}}{0,01}=10^{-12}\left(M\right)\)
\(\Rightarrow pH=-log\left[H^+\right]=12\)
Đúng 2
Bình luận (0)
trộn 200ml dung dịch HCl 0,2M với V lít dung dịch Y gồm KOH 0,1M và Ba(OH)2 0,05M . Dung dịch có pH=2 . Tính V?
trộn 500ml dd H2SO4 chứa 0,098g chất vào 200ml dd HnO3 0,04M. Xác định pH sau khi trộn
Ta có: \(\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{0,098}{98}=0,001\left(mol\right)\\n_{HNO_3}=0,2.0,04=0,008\left(mol\right)\end{matrix}\right.\)
=> \(\sum n_{H^+}=2n_{H_2SO_4}+n_{HNO_3}=0,01\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,01}{0,5+0,2}=\dfrac{1}{70}M\)
=> \(pH=-\log\left(\dfrac{1}{70}\right)=1,845\)
Đúng 0
Bình luận (0)
Tính pH của dung dịch: Trộn lẫn 250ml dung dịch KOH 1M và 250ml dung dịch H2SO4 1M. Tính pH của dung dịch thu được. Kết luận về môi trường của dung dịch sau phản ứng?
Ta có: \(n_{KOH}=n_{H_2SO_4}=0,25\left(mol\right)\)
PT: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,25}{2}< \dfrac{0,25}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=\dfrac{1}{2}n_{KOH}=0,125\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,25-0,125=0,125\left(mol\right)\)
\(\Rightarrow n_{H^+}=0,125.2=0,25\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,25}{0,25+0,25}=0,5\left(M\right)\)
\(\Rightarrow pH=-\log\left(0,5\right)\approx0,3\)
→ Vậy: Dd sau pư có MT axit.
Đúng 1
Bình luận (0)
Bài 24: Trộn 150 ml dd gồm Ba(OH)2 và KOH có pH = 12 với 350 ml dd gồm HNO3 0,02M và H2SO4 0,01M. Tính pH của dung dịch thu được?
\(n_{OH^-}=0,15.10^{-2}\)
\(n_{H^+}=0,35.\left(0,02+0,01.2\right)=0,014\)
\(n_{H^+d\text{ư}}=0,014-0,15.10^{-2}=0,0125\Rightarrow\left[H^+\right]d\text{ư}=\dfrac{0,0125}{0,15+0,35}=0,025\)
\(\Rightarrow pH\approx1,6\)
Đúng 1
Bình luận (0)
Trộn lẫn 20g dd HNO3 31,5% với 200ml dd Ba(OH)2 0,5M. Tính pH của dd thu được.
Ta có: \(\left\{{}\begin{matrix}n_{H^+}=n_{HNO_3}=\dfrac{20.31,5\%}{63}=0,1\left(mol\right)\\n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,5.0,2.2=0,2\left(mol\right)\end{matrix}\right.\)
PTHH: \(H^++OH^-\rightarrow H_2O\)
0,1--->0,1
`=>` \(n_{OH^-\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
Đề thiếu Vdd HNO3 nên không tính được Vdd sau phản ứng , không tìm được pH
Đúng 0
Bình luận (0)
Trộn lẫn 350 ml dd có chứa 2,45g H2SO4 với 150ml dd NaOH 0,3M. Tính pH của dd thu được.
\(n_{H_2SO_4}=\dfrac{2,45}{98}=0,025\left(mol\right)\Rightarrow n_{H^+}=0,025\cdot2=0,05\left(mol\right)\)
\(n_{NaOH}=0,3\cdot0,15=0,045=n_{OH^-}\)
PT ion RG: \(H^++OH^-\rightarrow H_2O\)
0,045 ← 0,045
\(\Rightarrow n_{H^+\text{ (dư)}}=0,05-0,045=0,005\left(mol\right)\)
\(\Rightarrow\left[H^+\right]_{\text{(dư)}}=\dfrac{0,005}{0,35+0,15}=0,01\left(M\right) \)
\(\Rightarrow pH=-\log0,01=2\)
Đúng 0
Bình luận (0)
câu 1
a, Tính pH của 100 ml dung dịch X gồm NaOH 0,04M và KOH 0,06M
b, Tính pH của 200 ml dung dịch Y chứa H2SO4 0,05M và HCI 0,1M
a) \(\left[OH^-\right]=0,04+0,06=0,1M=10^{-1}M\)
`=>` \(pOH=1\Rightarrow pH=14-1=13\)
b) \(\left[H^+\right]=0,05.2+0,1=0,2M\)
`=>` \(pH=-log\left(0,2\right)=0,7\)
Đúng 1
Bình luận (0)
a) \(\Sigma\left[OH^-\right]=0,1M\)
\(\Rightarrow\left[H^+\right]=\dfrac{10^{-14}}{0,1}=10^{-13}\Rightarrow pH=13\)
b) \(\Sigma\left[H^+\right]=0,2M\)
\(\Rightarrow pH=-\log\left(0,2\right)=0,7\)
Đúng 0
Bình luận (0)
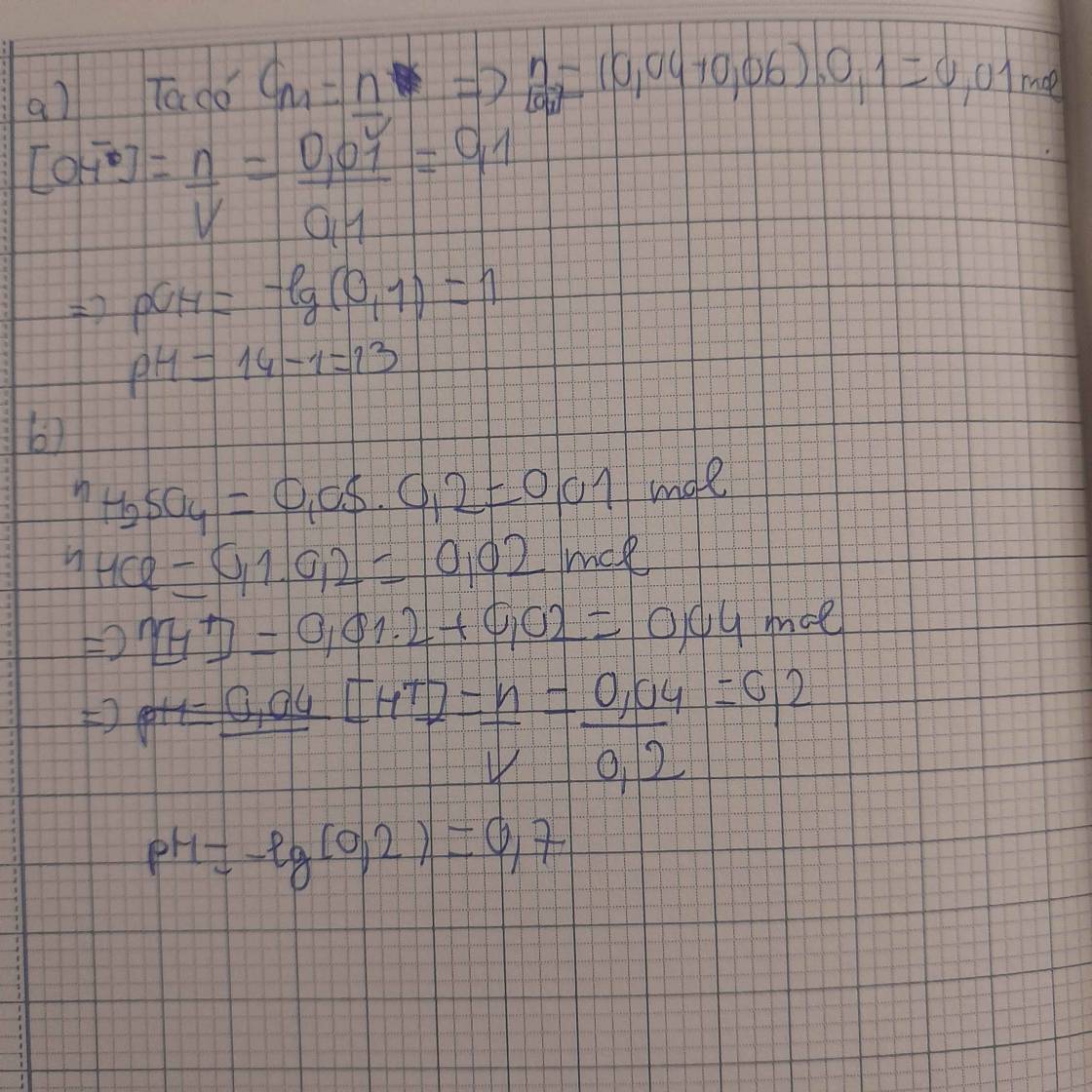 đây nhaa. Chữ có xấu xíu với hơi gạch xóa mong bạn thông cảm nhaaa
đây nhaa. Chữ có xấu xíu với hơi gạch xóa mong bạn thông cảm nhaaa
Đúng 0
Bình luận (0)