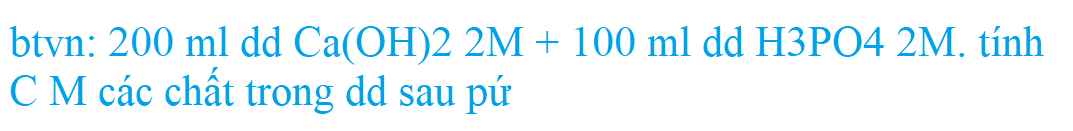Bài 6 SGK hóa 9 trang 76
Đề bài : Nung hỗn hợp gồm 5,6 g Fe và 1,6 g S trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dd HCL 1M phản ứng vừa đủ với A thu được hỗn hợp khí B
a) Hãy viết các phương trình hóa học
b) tính thể tích dd HCL 1M đã tham gia phản ứng
GIẢI
a) Fe + S ----> FeS (qua t°)
Fe + 2HCL ----> FeCl2 + H2
b) nS = m/M = 1,6/32 = 0,05 ( mol)
Vì nS = nFe(pư) => nFe(pư) = 0,05 mol
mFe(pư) = n.M = 0,05.56 = 2,8 (g)
=> mFe(dư) = 5,6 - 2,8 = 2,8 (g)
nFe(dư) = m/M = 2,8/5,6 = 0,05 mol
Vì nHCl = nFe(dư).2
=> nHCl = 0,05 .2 = 0,1 mol
=> V HCl = n.22,4 = 0,1 . 22,4 = 2,24 (l)
Vậy thể tích của HCl 1M đã phản ứng là 2,24 l
nFe=5,6:56=0,1 mol
n S=1,6:32+0,05 mol\
có phương trình:Fe+S→FeS (có nhiệt độ)
Ban đầu 0,1 0,05 (mol)
Pư 0,05 0,05 0,05 (mol)
Sau pư 0,05 0 0,05 (mol)
Chất rắn A gồm : Fe và FeS
Fe+2HCl→FeCl2+H2
0,05→0,1 (mol)
FeS +2HCl→FeCl2+H2S
0,05→0,1 (mol)
nHCl=0,1 +0,1= 0,2 mol
→Vdd HCl= 0,2 :1=0,2 l