Bài 29. Axit cacbonic và muối cacbonat
Nội dung lý thuyết
Các phiên bản khácỞ bài học này chúng ta hãy cùng đi tìm hiểu xem Axit cacbonic và muối cacbonat có những tính chất và ứng dụng gì?
I. AXIT CACBONIC (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
Trong nước mưa hay nước tự nhiên có chứa một lượng nhỏ axit cacbonic , cứ 1 lít nước hòa tan được 90ml khí CO2 có trong khí quyển và một phần khí CO2 tác dụng với nước để hình thành axit cacbonic H2CO3, còn lại phần lớn CO2 vẫn tồn tại trong khí quyển. Khi đun nóng thì khí CO2 lại bay ra khỏi dung dịch.
.jpg)
2. Tính chất hóa học
H2CO3 là một axit yếu: Dung dịch H2CO3 làm quỳ tím chuyển thành màu đỏ nhạt.
H2CO3 là một axit không bền: khi tham gia các phản ứng hóa học thì nhanh chóng bị phân hủy thành CO2 và H2O.
CO2 + H2O ⇌ H2CO3 (phản ứng thuận nghịch)
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
@728766@
II. MUỐI CACBONAT
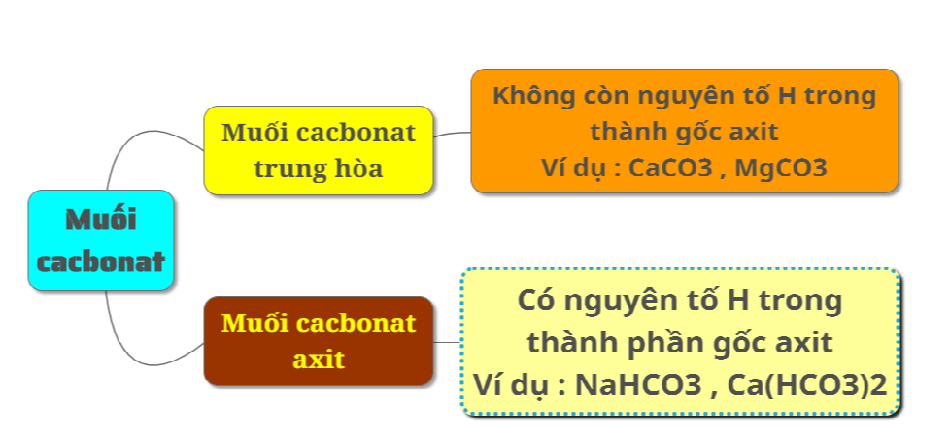
1. Phân loại
Có 2 loại muối: muối cacbonat trung hòa gọi là muối cacbonat và muối cacbonat axit gọi là muối hidrocacbonat.
2. Tính chất
a. Tính tan

b. Tính chất hóa học
- Tác dụng với axit
Tiến hành thí nghiệm cho NaHCO3 và Na2CO3 lần lượt tác dụng với HCl
Video 1: Thí nghiệm phản ứng của NaHCO3 với HCl. Video 2: Thí nghiệm phản ứng của Na2CO3 với HCl.
Hiện tượng: Có bọt khí không màu thoát ra ở cả hai thí nghiệm là khí cacbonic (CO2).
Giải thích: Khí CO2 thoát ra là vì xảy ra phản ứng hóa học sau:
NaHCO3(dd) + HCl(dd) NaCl(dd) + CO2(k) + H2O(l)
Na2CO3(dd) + 2HCl(dd) 2NaCl(dd) + CO2(k) + H2O(l)
Nhận xét: Muối cacbonat tác dụng với dung dịch axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng CO2.
- Tác dụng với dung dịch bazo
Tiến hành thí nghiệm của K2CO3 với Ca(OH)2

Kết tủa vẩn đục màu trắng khi cho K2CO3 tác dụng với Ca(OH)2
Giải thích: Do có phản ứng hóa học:
K2CO3(dd) + Ca(OH)2(dd) CaCO3(rắn) + 2KOH(dd)
Nhận xét: Một số dung dịch muối cacbonat phản ứng với dung dịch bazo tạo thành muối cacbonat không tan và dung dịch bazo mới.
Chú ý: Muối hidrocacbonat tác dụng với dung dịch kiềm tạo thành muối trung hòa và nước.
Ví dụ: NaHCO3(dd) + NaOH(dd) Na2CO3(dd) + H2O(l)
- Tác dụng với dung dịch muối
Cho dung dịch Na2CO3 tác dụng với dung dịch CaCl2.
Hiện tượng: Có vẩn đục kết tủa trắng xuất hiện.
Phương trình hóa học: Na2CO3(dd) + CaCl2(dd) CaCO3(r) + NaCl(dd)
Nhận xét: Dung dịch muối cacbonat có thể tác dụng với một số dung dịch muối tạo thành hai muối mới.
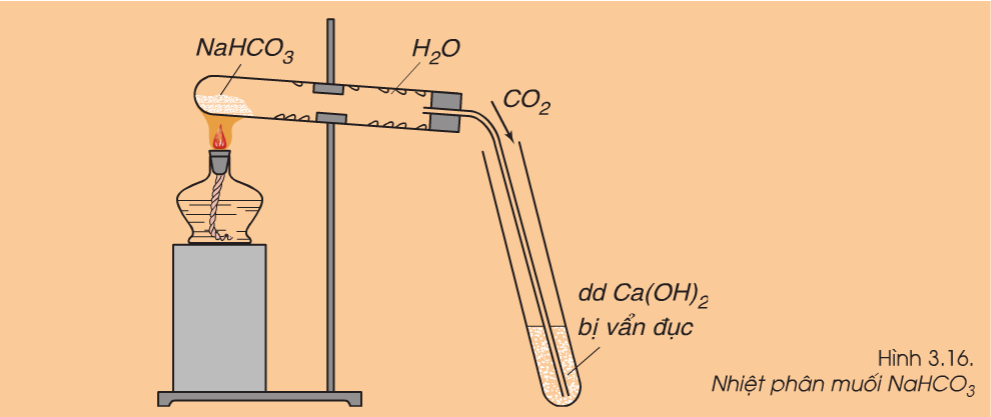
- Muối cacbonat bị nhiệt phân hủy
Nhiều muối cacbonat (trừ muối cacbonat trung hòa của kim loại kiềm) dễ bị nhiệt phân hủy giải phóng khí CO2.
Ví dụ : CaCO3(r) CaO(r) + CO2(k)
2KHCO3(r) K2CO3(r) + H2O(h) + CO2(k)
2NaHCO3(r) Na2CO3(r) + H2O(h) + CO2(k)
3. Ứng dụng
Các muối cacbonat có nhiều ứng dụng trong đời sống: CaCO3 là thành phần chính của đá vôi, đá phấn dùng làm nguyên liệu để sản xuất vôi, xi măng , Na2CO3 dùng để sản xuất xà phòng , nấu thủy tinh , NaHCO3 dùng làm dược phẩm ( thuốc chữa đau dạ dày do thừa axit) , hóa chất trong bình cứu hỏa...

@728834@@728910@@728970@
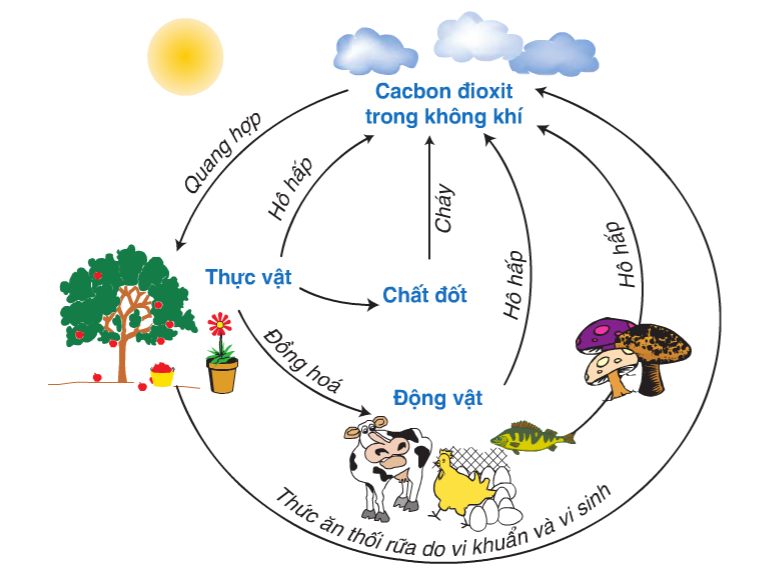
III. CHU TRÌNH CACBON TRONG TỰ NHIÊN
Trong tự nhiên có sự chuyển hóa cacbon từ dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên , liên tục và được tạo thành chu trình khép kín.
IV. Tổng kết
1. H2CO3 là axit yếu, không bền, dễ bị phân huỷ thành CO2 và H2O.
2. Muối cacbonat có những tính chất hoá học sau: tác dụng với dung dịch axit mạnh, với dung dịch bazơ, dung dịch muối; dễ bị nhiệt phân huỷ giải phóng khí CO2 (trừ Na2CO3, K2CO3...).
3. Một số muối cacbonat dược dùng làm nguyên liệu sản xuất vôi, xi măng, xà phòng, thuốc chữa bệnh, bình cứu hoả, v.v...
Trong quá trình học tập , nếu có bất kỳ thắc mắc nào , các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé . Chúc các em học tốt !