Làm thế nào có thể so sánh sự nhanh, chậm của các phản ứng hóa học để thúc đẩy hoặc kìm hãm nó theo mong muốn?
Bài 19: Tốc độ phản ứng
H24
Hướng dẫn giải
Thảo luận (1)
H24
Xét phản ứng H2 + Cl2 → 2HCl
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
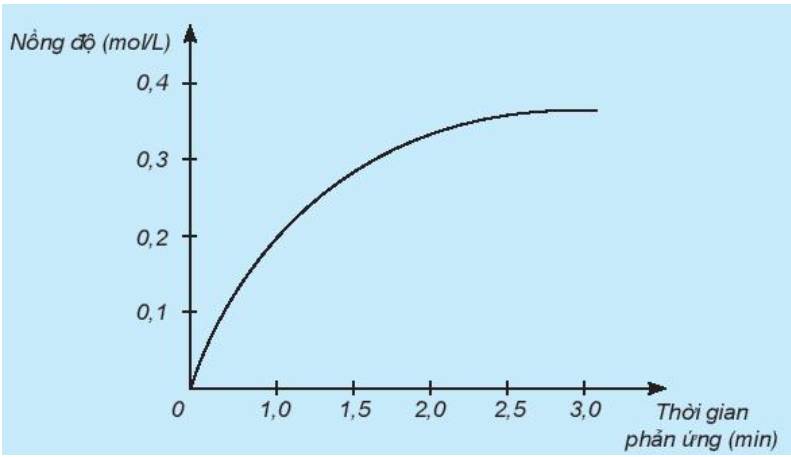 a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b) Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Hướng dẫn giải
Thảo luận (1)
a) Theo thời gian, nồng độ có xu hướng tăng dần
=> Đồ thị mô tả sự thay đổi nồng độ theo thời gian của sản phẩm HCl
b) Đơn vị của tốc độ phản ứng trong trường hợp này là phút (min).
Trả lời bởi Mai Trung Hải Phong
H24
Phản ứng phân hủy H2O2:H2O2 → H2O + ½ O2Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trên Bảng 19.1 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:0,707 – 1,000 - 0,293 (mol/L)(Dấu “ – “ thể hiện rằng nồng độ H2O2 giảm dần khi phản ứng xảy ra.)Tốc độ phản ứng trong khoảng thời gian từ 0 giờ đến 3 giờ được tính như sau:(Dấu “ – “ trước biểu thức để tốc độ phản ứng có giá trị dương)Trả lời câu hỏi:1. Hãy tính tốc độ phản ứng theo nồng độ H2O2 tro...
Đọc tiếp
Phản ứng phân hủy H2O2:
H2O2 → H2O + ½ O2
Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trên Bảng 19.1
 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
0,707 – 1,000 = - 0,293 (mol/L)
(Dấu “ – “ thể hiện rằng nồng độ H2O2 giảm dần khi phản ứng xảy ra.)
Tốc độ phản ứng trong khoảng thời gian từ 0 giờ đến 3 giờ được tính như sau:
(Dấu “ – “ trước biểu thức để tốc độ phản ứng có giá trị dương)
Trả lời câu hỏi:
1. Hãy tính tốc độ phản ứng theo nồng độ H2O2 trong các khoảng thời gian từ:
a) 3 giờ đến 6 giờ.
b) 6 giờ đến 9 giờ.
c) 9 giờ đến 12 giờ.
2. Nhận xét về sự thay đổi tốc độ phản ứng theo thời gian.
Hướng dẫn giải
Thảo luận (1)
1.
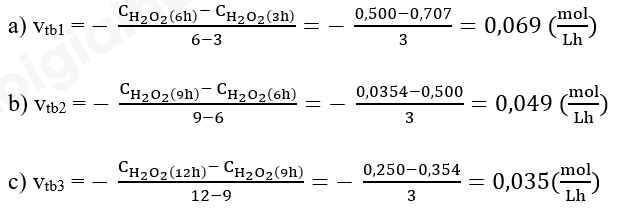
2.
Ta thấy: vtb1 > vtb2 > vtb3 => Tốc độ phản ứng giảm dần theo thời gian
Trả lời bởi Mai Trung Hải Phong
H24
Cho phản ứng của các chất ở thể khí:
2NO + 2H2 → N2 + 2H2O
Hãy viết biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên.
Hướng dẫn giải
Thảo luận (1)
Gọi ∆CNO, ∆CH2, ∆CN2, ∆CH2O lần lượt là biến thiên nồng độ các chất NO, H2, N2 và H2O trong khoảng thời gian . Tốc độ trung bình của phản ứng được tính theo biểu thức: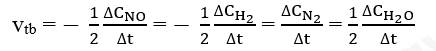
H24
Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2OChuẩn bị: Các dung dịch Na2SO3 0,05 M, Na2SO3 0,10 M, Na2SO3 0,30 M, H2SO4 0,5 M; 3 bình tam giác, đồng hồ bấm giờ, tờ giấy trắng có kẻ chữ X.Tiến hành:- Cho vào mỗi bình tam giác 30 mL dung dịch Na2SO3 với các nồng độ tương ứng là 0,05 M; 0,10 M và 0,30 M. Đặt các bình lên tờ giấy trắng có kẻ sẵn chữ X.- Rót nhannh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M và bắt đầu bấm giờ.Lưu ý: Phản ứng có sinh...
Đọc tiếp
Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:
Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Chuẩn bị: Các dung dịch Na2SO3 0,05 M, Na2SO3 0,10 M, Na2SO3 0,30 M, H2SO4 0,5 M; 3 bình tam giác, đồng hồ bấm giờ, tờ giấy trắng có kẻ chữ X.
Tiến hành:
- Cho vào mỗi bình tam giác 30 mL dung dịch Na2SO3 với các nồng độ tương ứng là 0,05 M; 0,10 M và 0,30 M. Đặt các bình lên tờ giấy trắng có kẻ sẵn chữ X.
- Rót nhannh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M và bắt đầu bấm giờ.
Lưu ý: Phản ứng có sinh ra khí độc. Cần tiến hành cẩn thận và tránh ngửi trực tiếp trên miệng bình tam giác.
 Quan sát vạch chữ X trên tờ giấy dưới đáy bình, ghi lại thời điểm không nhìn thấy vạch chữ X nữa và trả lời câu hỏi:
Quan sát vạch chữ X trên tờ giấy dưới đáy bình, ghi lại thời điểm không nhìn thấy vạch chữ X nữa và trả lời câu hỏi:
1. Phản ứng ở bình nào xảy ra nhanh nhất? Chậm nhất?
2. Nồng độ ảnh hưởng thế nào đến tốc độ phản ứng
Hướng dẫn giải
Thảo luận (1)
1.
Phản ứng ở bình Na2SO3 0,3 M xảy ra nhanh nhất
Phản ứng ở bình Na2SO3 0,05 M xảy ra chậm nhất
2.
Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn đến tốc độ phản ứng tăng.
Trả lời bởi Mai Trung Hải Phong
H24
Cho phản ứng của các chất ở thể khí: X + Y → XYBiết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.a) Hãy viết phương trình tốc độ của phản ứng này.b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:- Tại thời điểm đầu.- Tại thời điểm đã hết một nửa lượng X.
Đọc tiếp
Cho phản ứng của các chất ở thể khí: X + Y → XY
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng X.
Hướng dẫn giải
Thảo luận (1)
a) v = k . CX.CY
Trong đó k là hằng số tốc độ phản ứng
CX.CY lần lượt là nồng độ của X và Y tại một thời điểm đang xét
b)
- Tốc độ phản ứng tại thời điểm đầu:
v = k . CX.CY = 2,5 . 10-4 . 0,02 . 0,03 = 1,5 . 10-7(mol/(Ls))
- Tốc độ phản ứng tại thời điểm hết một nửa lượng X
=> CX= 0,01 M
CY = 0,02 M
v = k . CX.CY = 2,5 . 10-4 . 0,01 . 0,02 = 5.10-8(mol/(Ls))
Trả lời bởi Mai Trung Hải Phong
H24
Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp.
Hướng dẫn giải
Thảo luận (1)
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên.
Trả lời bởi Mai Trung Hải Phong
H24
Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
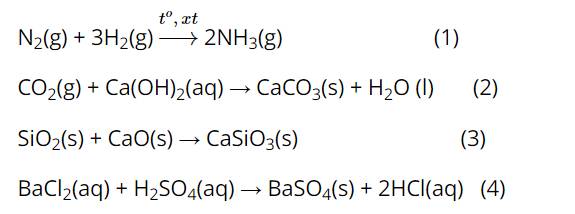
Hướng dẫn giải
Thảo luận (1)
Phản ứng (1) và (2) có sự tham gia của chất khí
=> Áp suất ảnh hưởng đến tốc độ phản ứng (1) và (2).
Trả lời bởi Mai Trung Hải Phong
H24
Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng:Mg + 2H2O → Mg(OH)2 + H2Chuẩn bị: Mg dạng phôi bào, dung dịch phenolphthalein, nước cất, 2 ống nghiệm, đèn cồn, kẹp gỗ.Tiến hành:Cho vào mỗi ống nghiệm khoảng 3 mL nước cất.Nhỏ vào mỗi ống nghiệm 1 – 2 giọt phenolphthalein và cho vào mỗi ống 1 mẫu phoi bào Mg.Đun nóng 1 ống nghiệm.Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí nghiệm.Quan sát và trả lời câu hỏi:1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?2. Nhiệt độ ảnh hưởng nh...
Đọc tiếp
Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng:
Mg + 2H2O → Mg(OH)2 + H2
Chuẩn bị: Mg dạng phôi bào, dung dịch phenolphthalein, nước cất, 2 ống nghiệm, đèn cồn, kẹp gỗ.
Tiến hành:
Cho vào mỗi ống nghiệm khoảng 3 mL nước cất.
Nhỏ vào mỗi ống nghiệm 1 – 2 giọt phenolphthalein và cho vào mỗi ống 1 mẫu phoi bào Mg.
Đun nóng 1 ống nghiệm.
Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí nghiệm.
Quan sát và trả lời câu hỏi:
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Hướng dẫn giải
Thảo luận (1)
1. Sự thay đổi màu sắc trong ống nghiệm được đung nóng nhanh hơn.
2. Khi nhiệt độ tăng, tốc độ phản ứng sẽ tăng lên
Trả lời bởi Mai Trung Hải Phong
H24
Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng.
Hướng dẫn giải
Thảo luận (1)
Vì khi nhiệt độ tăng, tốc độ chuyển động của các phân tử tăng làm cho các phân tử di chuyển hỗn loạn và va chạm với nhau nhiều hơn và mạnh hơn, từ đó làm cho phản ứng xảy ra nhanh chóng hơn.
Trả lời bởi Bảo Chu Văn An
Thời gian là đại lượng để xác định sự nhanh, chậm của các phản ứng hóa học.
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc sản phẩm trong một đơn vị thời gian: giây(s), phút (min), giờ (h), ngày(d),..
Trả lời bởi Mai Trung Hải Phong