Gọi ∆CNO, ∆CH2, ∆CN2, ∆CH2O lần lượt là biến thiên nồng độ các chất NO, H2, N2 và H2O trong khoảng thời gian . Tốc độ trung bình của phản ứng được tính theo biểu thức: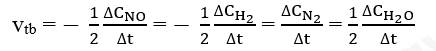
Bài 19: Tốc độ phản ứng
Đúng 1
Bình luận (0)
Các câu hỏi tương tự
Cho phản ứng của các chất ở thể khí: X + Y → XYBiết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.a) Hãy viết phương trình tốc độ của phản ứng này.b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:- Tại thời điểm đầu.- Tại thời điểm đã hết một nửa lượng X.
Đọc tiếp
Cho phản ứng của các chất ở thể khí: X + Y → XY
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng X.
Xét phản ứng H2 + Cl2 → 2HCl
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
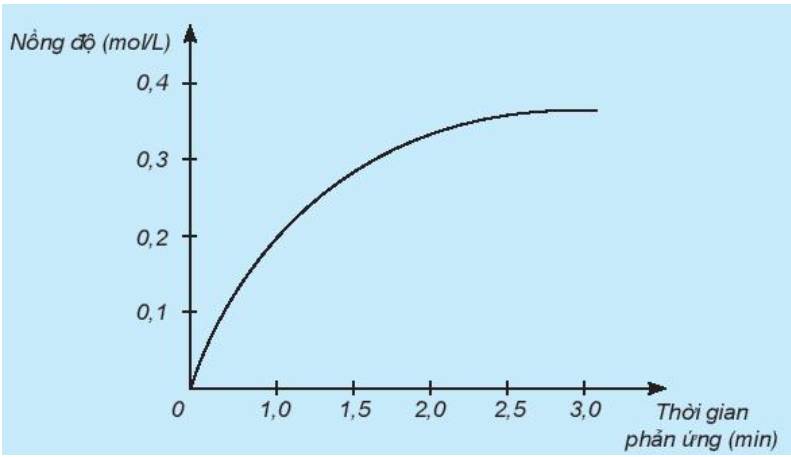 a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b) Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Phản ứng phân hủy H2O2:H2O2 → H2O + ½ O2Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trên Bảng 19.1 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:0,707 – 1,000 - 0,293 (mol/L)(Dấu “ – “ thể hiện rằng nồng độ H2O2 giảm dần khi phản ứng xảy ra.)Tốc độ phản ứng trong khoảng thời gian từ 0 giờ đến 3 giờ được tính như sau:(Dấu “ – “ trước biểu thức để tốc độ phản ứng có giá trị dương)Trả lời câu hỏi:1. Hãy tính tốc độ phản ứng theo nồng độ H2O2 tro...
Đọc tiếp
Phản ứng phân hủy H2O2:
H2O2 → H2O + ½ O2
Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trên Bảng 19.1
 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
0,707 – 1,000 = - 0,293 (mol/L)
(Dấu “ – “ thể hiện rằng nồng độ H2O2 giảm dần khi phản ứng xảy ra.)
Tốc độ phản ứng trong khoảng thời gian từ 0 giờ đến 3 giờ được tính như sau:
(Dấu “ – “ trước biểu thức để tốc độ phản ứng có giá trị dương)
Trả lời câu hỏi:
1. Hãy tính tốc độ phản ứng theo nồng độ H2O2 trong các khoảng thời gian từ:
a) 3 giờ đến 6 giờ.
b) 6 giờ đến 9 giờ.
c) 9 giờ đến 12 giờ.
2. Nhận xét về sự thay đổi tốc độ phản ứng theo thời gian.
Ở 20 oC, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30oC, tốc độ phản ứng này là 0,15 mol/(L.min).
a) Hãy tính hệ số nhiệt độ Van’t Hoff của phản ứng trên.
b) Dự đoán tốc độ phản ứng trên ở 40oC (giả thiết hệ số nhiệt độ γ trong khoảng nhiệt độ này không đổi).
Giải thích được tại sao nhiều phản ứng hoá học trong công nghiệp cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác.
Nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản ứng2H2O2 → 2H2O + O2Chuẩn bị: 2 bình tam giác, dung dịch H2O2 10%, MnO2.Tiến hành:Rót vào 2 bình tam giác, mỗi bình 20 mL dung dịch H2O2 10%.Thêm khoảng 0,1 g xúc tác MnO2 vào một bình và lắc đều.Quan sát hiện tượng và trả lời câu hỏi:1. So sánh tốc độ thoát khí ở hai bình.2. Chất xúc tác ảnh hưởng thế nào đến tốc độ phản ứng?
Đọc tiếp
Nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản ứng
2H2O2 → 2H2O + O2
Chuẩn bị: 2 bình tam giác, dung dịch H2O2 10%, MnO2.
Tiến hành:
Rót vào 2 bình tam giác, mỗi bình 20 mL dung dịch H2O2 10%.
Thêm khoảng 0,1 g xúc tác MnO2 vào một bình và lắc đều.
Quan sát hiện tượng và trả lời câu hỏi:
1. So sánh tốc độ thoát khí ở hai bình.
2. Chất xúc tác ảnh hưởng thế nào đến tốc độ phản ứng?
Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Yếu tố nào đã được áp dụng để làm thay đổi tốc độ của các phản ứng trong Hình 19.7?
Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng.


