Câu 1. Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm?
(a) Đốt cháy nhiên liệu.
(b) Sắt bị gỉ.
(c) Trung hòa acid - base
Câu 1. Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm?
(a) Đốt cháy nhiên liệu.
(b) Sắt bị gỉ.
(c) Trung hòa acid - base
Câu 2. Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
a: Tốc độ phản ứng tăng lên do bề mặt tiếp xúc tăng lên
b: Tốc độ phản ứng giảm xuống do nồng độ giảm
c: Tốc độ phản ứng tăng lên do nhiệt độ tăng
Trả lời bởi Nguyễn Lê Phước ThịnhCâu 3. Hydrogen peroxide phân hủy theo phản ứng: 2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
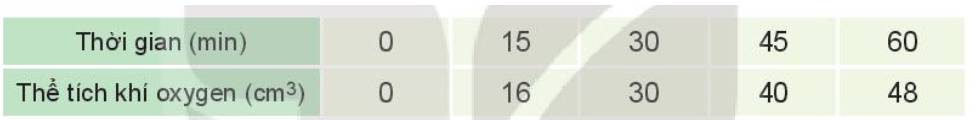
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong khoảng thời gian:
- Từ 0 – 15 phút
- Từ 15 – 30 phút
- Từ 30 – 45 phút
- Từ 45 – 60 phút
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
a) Đồ thị em vẽ mãi không được a tham khảo tí nhé :v
Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian: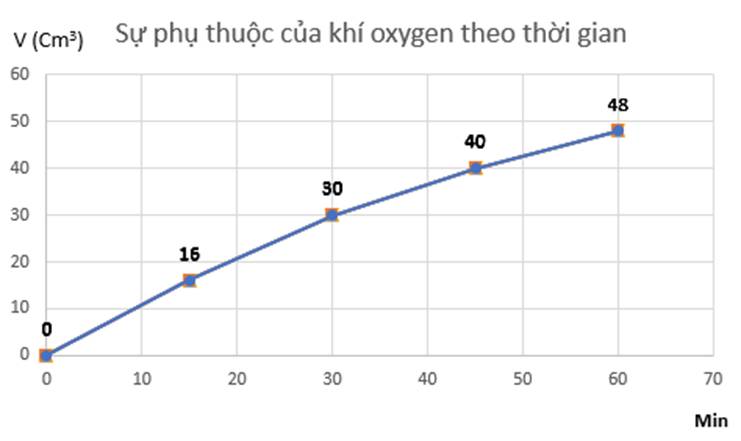 b)
b)
Ta có công thức tính vận tốc trung bình: \(V_{tb}=\dfrac{S_1+S_2....}{t_1+t_2....}\)
Tốc độ trung bình của phản ứng từ 0 - 15 phút là:
\(V_{tb_1}=\dfrac{16-0}{15-0}=1,0666....\approx1,067\) (cm3/min)
Tốc độ trung bình của phản ứng từ 15 - 30 phút là:
\(V_{tb_2}=\dfrac{30-16}{30-15}=0,9333....\approx0,933\) (cm3/min)
Tốc độ trung bình của phản ứng từ 30 - 45 phút là:
\(V_{tb_3}=\dfrac{40-30}{45-30}=0,66666.....\approx0,667\) (cm3/min)
Tốc độ trung bình của phản ứng từ 45 - 60 phút là:
\(V_{tb_4}=\dfrac{48-40}{60-45}=0,5333.....\approx0,533\) (cm3/min)
Ta thấy \(V_{tb_1}>V_{tb_2}>V_{tb_3}>V_{tb_4}\)
=> Tốc độ trung bình của phản ứng giảm dần theo thời gian.
Câu 4. Hãy thiết kế một thí nghiệm để chứng minh ảnh hưởng của nhiệt độ đến tốc độ phản ứng của zinc và sulfuric acid loãng.
Chuẩn bị: 2 ống nghiệm, 2 kẹp gỗ, 1 đèn cồn, 4 gam Zn hạt và dung dịch H2SO4 loãng 0,1 M.
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống 5mL H2SO4 0,1M
- Cho cùng một lượng (2 gam) zinc dạng viên vào ống nghiệm (1) và (2).
- Đun nóng 1 ống nghiệm
Kết quả: Ống nghiệm dược đun nóng sẽ thoát khí nhanh hơn.
Trả lời bởi Mai Trung Hải PhongCâu 5. Một phản ứng ở 45oC có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van’t Hoff của phản ứng bằng 2.
(a) Đốt cháy nhiên liệu (nhanh)
(b) Sắt bị gỉ(chậm)
(c) Trung hòa acid – base(nhanh)
Trả lời bởi Tuyet