Từ cấu tạo phân tử halogen và đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết của nguyên tử halogen trong các phản ứng hóa học.
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
Bài 17: Tính chất vật lý và hoá học các đơn chất nhóm VIIA
H24
Hướng dẫn giải
Thảo luận (1)
H24
Trong phản ứng với kim loại, nhận xét sự biến đổi số oxi hóa của nguyên tử các nguyên tố halogen và viết các quá trình khử xảy ra.
Hướng dẫn giải
Thảo luận (1)
- Trong phản ứng với kim loại, các halogen từ số oxi hóa 0 sẽ nhận thêm 1 electron thành số oxi hóa -1
- Sơ đồ:
F + 1e → F-
Cl + 1e → Cl-
Br + 1e → Br-
I + 1e → I-
Trả lời bởi Mai Trung Hải Phong
H24
Dựa vào điều kiện phản ứng với hydrogen và giá trị năng lượng liên kết của phân tử H – X, giải thích khả năng phản ứng của các halogen với hydrogen.
Hướng dẫn giải
Thảo luận (1)
- Đi từ F đến I
+ Điều kiện phản ứng với hydrogen khó dần
+ Năng lượng liên kết H-X giảm dần => Độ bền H-X giảm dần
=> Khả năng phản ứng của các halogen với hydrogen giảm dần
Trả lời bởi Mai Trung Hải Phong
H24
Trong phản ứng với dung dịch kiềm, nhận xét sự biến đổi số oxi hóa của chlorine và cho biết phản ứng này thuộc loại phản ứng gì?
Hướng dẫn giải
Thảo luận (1)
H24
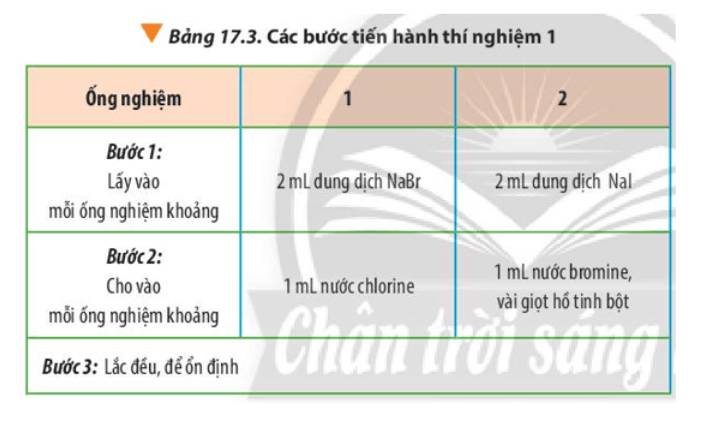
Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng.Thí nghiệm 1: So sánh tính chất hóa học của halogenHóa chất: dung dịch NaBr, NaI, nước chlorine, nước bromine và dung dịch hồ tinh bột.Dụng cụ: ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.Tiến hành: Thực hiện các bước theo Bảng 17.3
Đọc tiếp
Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng.
Thí nghiệm 1: So sánh tính chất hóa học của halogen
Hóa chất: dung dịch NaBr, NaI, nước chlorine, nước bromine và dung dịch hồ tinh bột.
Dụng cụ: ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.
Tiến hành: Thực hiện các bước theo Bảng 17.3
Hướng dẫn giải
Thảo luận (1)
- Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt
- Ống nghiệm 2: dung dịch không màu chuyển thành vàng, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím
Trả lời bởi Mai Trung Hải Phong
H24
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 1.
Hướng dẫn giải
Thảo luận (1)
- Giải thích kết quả:
+ Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt của Br2
Cl2 + 2NaBr → 2NaCl + Br2
+ Ống nghiệm 2: dung dịch không màu chuyển thành vàng của I2, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím do I2 làm đổi màu hồ tinh bột
Br2 + 2NaI → 2NaBr + I2
Trả lời bởi Mai Trung Hải Phong
H24
Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.Thí nghiệm 2: Tính tẩy màu của khí chlorine ẩmHóa chất: tinh thể potassium permanganate (KMnO4), dung dịch HCl đặc, giấy màu, nước cất.Dụng cụ: ống nghiệm 2 nhánh, nút cao su, giá đỡ, thìa thủy tinh, ống hút nhỏ giọt.Tiến hành:Bước 1: Dùng thìa thủy tinh lấy một ít tinh thể KMnO4, cho vào nhánh dài của ống nghiệm. Dùng ống hút nhỏ giọt lấy khoảng 1 mL dung dịch HCl đặc cho vào nhánh ngắn của ống nghiệm. Lắp dụng cụ để điều chế khí Cl2 ẩm nh...
Đọc tiếp
Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.
Thí nghiệm 2: Tính tẩy màu của khí chlorine ẩm
Hóa chất: tinh thể potassium permanganate (KMnO4), dung dịch HCl đặc, giấy màu, nước cất.
Dụng cụ: ống nghiệm 2 nhánh, nút cao su, giá đỡ, thìa thủy tinh, ống hút nhỏ giọt.
Tiến hành:
Bước 1: Dùng thìa thủy tinh lấy một ít tinh thể KMnO4, cho vào nhánh dài của ống nghiệm. Dùng ống hút nhỏ giọt lấy khoảng 1 mL dung dịch HCl đặc cho vào nhánh ngắn của ống nghiệm. Lắp dụng cụ để điều chế khí Cl2 ẩm như Hình 17.4.
Lưu ý: Kiểm tra nút cao su phải được đậy kín trước khi thực hiện bước 2.
Bước 2: Nghiêng ống nghiệm sao cho dung dịch HCl tiếp xúc với KMnO4.
Phương trình hóa học của phản ứng điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O

Hướng dẫn giải
Thảo luận (1)
H24
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 2.
Hướng dẫn giải
Thảo luận (1)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2\uparrow+8H_2O\)
Khí clobay lên, tác dụng với nước tạo tạo thành hợp chất hỗn hợp có tính tẩy màu
\(Cl_2+H_2O\rightarrow HClO+HCl\)
=>kết quả là Giấy màu ẩm bị nhạt màu dần sau đó mất màu
Trả lời bởi Nguyễn Lê Phước Thịnh
H24
Viết phương trình hóa học của các phản ứng sau:Cu + Cl2 → (1)Al + Br2 → (2)Ca(OH)2 + Cl2 → (3)KOH + Br2 underrightarrow{70^oC} (4)Cl2 + KBr → (5)Br2 + NaI → (6)
Đọc tiếp
Viết phương trình hóa học của các phản ứng sau:
Cu + Cl2 → (1)
Al + Br2 → (2)
Ca(OH)2 + Cl2 → (3)
KOH + Br2 \(\underrightarrow{70^oC}\) (4)
Cl2 + KBr → (5)
Br2 + NaI → (6)
Hướng dẫn giải
Thảo luận (1)
(1) \(Cu+Cl_2\xrightarrow[]{t^\circ}CuCl_2\)
(2) \(2Al+3Br_2\xrightarrow[]{t^\circ}2AlBr_3\)
(3) \(Ca\left(OH\right)_2+Cl_2\rightarrow CaOCl_2+H_2O\)
(4) \(6KOH+3Br_2\xrightarrow[]{70^\circ C}KBrO_3+5KBr+3H_2O\)
(5) \(Cl_2+2KBr\xrightarrow[]{}2KCl+Br_2\)
(6) \(Br_2+2NaI\rightarrow2NaBr+I_2\)
Trả lời bởi Phước Lộc
H24
Tính tẩy màu của khí chlorine ẩm được ứng dụng vào lĩnh vực nào trong đời sống?
Hướng dẫn giải
Thảo luận (3)
Trả lời:
Tính tẩy màu của khí chlorine ẩm được ứng dụng:
+ Tẩy trắng sợi, vải, giấy.
+ Sản xuất chất tẩy rửa.
+ Tiệt trùng nước sinh hoạt, nước trong các bể bơi.
Trả lời bởi Toru
- Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm
Sơ đồ: X + 1e → X-
Trả lời bởi Mai Trung Hải Phong