Viết quá trình các ion halide bị oxi hóa thành đơn chất tương ứng.
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
Bài 18: Hydrogen halide và một số phản ứng của ion halide
H24
Hướng dẫn giải
Thảo luận (1)
H24
Phản ứng nào dưới đây chứng minh tính khử của các ion halide:
(1) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
(2) 2NaCl \(\underrightarrow{dpnc}\) 2Na + Cl2↑
(3) 2HBr + H2SO4 → Br2 + SO2↑ + 2H2O
(4) HI + NaOH → NaI + H2O
Hướng dẫn giải
Thảo luận (1)
H24
Dựa vào Bảng 17.2 và Bảng 18.1, nhận xét mối liên hệ giữa sự biến đổi năng lượng liên kết và độ dài liên kết H-X với sự biến đổi tính acid của các hydrohalic acid.
Hướng dẫn giải
Thảo luận (1)
Năng lượng liên kết H-x giảm dần từ HF đến HI
Độ dài liên kết cũng giảm dần từ HF đến HI
=>Tính axit cũng giảm dần từ HF đến HI
Trả lời bởi Nguyễn Lê Phước Thịnh
H24
Nhận xét sự thay đổi số oxi hóa của nguyên tử các nguyên tố halogen trong phản ứng của muối halide với dung dịch H2SO4 đặc.
Hướng dẫn giải
Thảo luận (1)
H24
Hoàn thành phương trình hóa học của các phản ứng sau:
(1) NaOH + HCl →
(2) Zn + HCl →
(3) CaO + HBr →
(4) K2CO3 + HI →
Hướng dẫn giải
Thảo luận (1)
(1) \(NaOH+HCl\rightarrow NaCl+H_2O\)
(2) \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
(3) \(CaO+2HBr\rightarrow CaBr_2+H_2O\)
(4) \(K_2CO_3+2HI\rightarrow2KI+H_2O+CO_2\uparrow\)
Trả lời bởi Phước Lộc
H24
Thông tin trong Bảng 18.1 cho biết độ tan của hydrogen fluoride trong nước ở 0oC là vô hạn. Giải thích nguyên nhân dẫn đến tính chất này.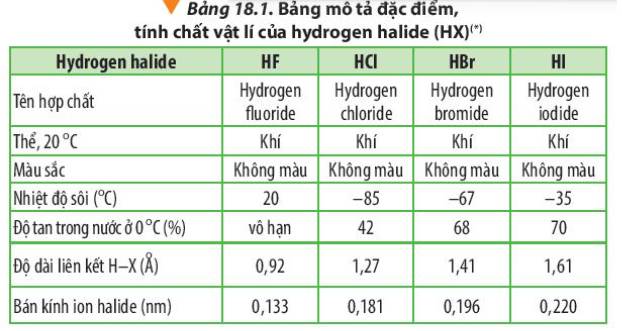
Hướng dẫn giải
Thảo luận (1)
Vì Fluorine là nguyên tố có độ âm điện lớn nhất nên liên kết H-F phân cực mạnh nhất. Do đó, nó tạo liên kết hydrogen bền với các phân tử H2O nên hydrogen fluoride (HF) tan vô hạn trong nước.
Trả lời bởi hnamyuh
H24
Dựa vào Bảng 18.1 và Hình 18.1, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào? Giải thích.
Hướng dẫn giải
Thảo luận (2)
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng
Trả lời bởi Mai Trung Hải Phong
H24
Thủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản. Trước đây, muốn khắc các hoa văn, cần phủ lên bề mặt thủy tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thủy tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thủy tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí. Quá trình ăn mòn thủy tinh xảy ra thế nào? Các ion halide có tí...
Đọc tiếp
Thủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản. Trước đây, muốn khắc các hoa văn, cần phủ lên bề mặt thủy tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thủy tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thủy tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí. Quá trình ăn mòn thủy tinh xảy ra thế nào? Các ion halide có tính chất gì? 
Hướng dẫn giải
Thảo luận (1)
- Hydrofluoric acid (HF) là acid rất yếu, nhưng có tính chất đặc biệt là ăn mòn thủy tinh, phương trình hóa học của phản ứng ăn mòn thủy tinh:
$SiO_2 + 4HF \to SiF_4 + 2H_2O$
- Tính chất của các ion halide: Trong ion halide, các halogen có số oxi hóa thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa – khử.
+ Tính khử của các ion halide tăng theo chiều: $F^- < Cl^- < Br^- < I^-$
Trả lời bởi hnamyuh
H24
Quan sát Hình 18.2, giải thích nhiệt độ sôi cao bất thường của hydrogen fluorine so với các hydrogen halide còn lại. 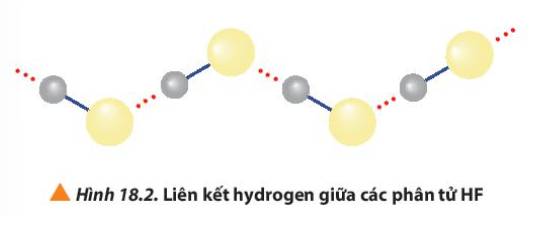
Hướng dẫn giải
Thảo luận (1)
Các phân tử hydrogen fluoride hình thành liên kết phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen flouride cao bất thường với các hydrogen halide còn lại.
Trả lời bởi hnamyuh
H24
Em hãy đề xuất cách bảo quản hydrofluoric aicd trong phòng thí nghiệm.
Hướng dẫn giải
Thảo luận (1)
- Cần sử dụng các biện pháp thông hút gió tốt ở nơi làm việc, làm sàn tường phòng làm bằng vật liệu chịu axit flohydric.
- Không sử dụng thủy tinh để chứa axit flohydric.
- Sử dụng các thiết bị bảo hộ cá nhân như: quần áo bảo hộ, kính mắt, găng tay và ủng cao su…
- Bảo quản hóa chất ở nơi khô ráo, tránh ánh sáng trực tiếp
Trả lời bởi hnamyuh
\(2Br^{-1}\rightarrow Br^0_2+2e\)
\(2I^{-1}\rightarrow I_2^0+2e\)
Trả lời bởi Nguyễn Lê Phước Thịnh