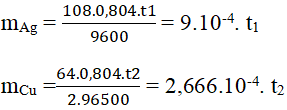Câu 27: Ngâm một lá trong 100ml dd AgNO3 0,1 mol/lit cho đến khi phản ứng kết thúc. Khối lượng Ag thu được là
CHƯƠNG 7 -SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
Kim loại thu được là Ag.
\(n_{Ag} = n_{AgNO_3} = 0,1.0,1 = 0,01(mol)\\ m_{Ag} = 0,01.108 = 1,08(gam)\)
Đúng 1
Bình luận (0)
Đốt cháy 2,15 gam hỗn hợp gồm Zn, Mg và Al trong khí oxi dư, thu được 3,43 gam hỗn hợp X. Cho X phản ứng vừa đủ với Vml dung dịch HCl 0,5M. Biết các phản ứng xảy ra hoàn toàn. Hỏi giá trị của V là bao nhiêu?
\(m_{O(trong\ oxit} = 3,43 -2,15 = 1,28(gam)\\ n_O = \dfrac{1,28}{16} = 0,08(mol)\\ 2H^+ + O^{2-} \to H_2O\\ n_{H^+} = 2n_O = 0,08.2 = 0,16(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,16}{0,5} = 0,32(lít) = 320(ml)\)
Đúng 3
Bình luận (0)
Cho 15,6 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 loãng dư thu được 0,3 mol H2. Cho 5,2 gam X tác dụng với dung dịch H2SO4 đặc nóng thu được khí SO2 (sản phẩm khử duy nhất) và dung dịch Z. Khối lượng Z thay đổi so với dung dịch H2SO4 ban đầu là bao nhiêu
Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.
Đúng 3
Bình luận (0)
Chỉ dùng thêm một thuốc thử nào sau đây thể phân biệt được các dung dịch: NaCl, FeCl2, FeCl3, CrCl3?
Trích mẫu thử
Cho dung dịch NaOH tới dư vào các mẫu thử
- mẫu thử nào tạo kết tủa nâu đỏ là FeCl3
\(FeCl_3 + 3KOH \to Fe(OH)_3 + 3KCl\)
- mẫu thử nào tạo kết tủa trắng xanh là FeCl2
\(FeCl_2 + 2KOH \to Fe(OH)_2 + 2KCl\)
- mẫu thử nào tạo kết tủa màu lục là CrCl3
\(CrCl_3 + 3KOH \to Cr(OH)_3 + 3KCl\)
- mẫu thử không hiện tượng là NaCl
Đúng 1
Bình luận (1)
Cho dd NaOH :
- Kết tủa trắng xanh , hoá nâu trong không khí : FeCl2
- Kết tủa nâu đỏ : FeCl3
- Kết tủa vàng : CrCl3
- Không HT : NaCl
Đúng 0
Bình luận (1)
Trích mẫu thử :
+Cho KOH dư vào mỗi dung dịch
-D2 nào xuất hiện kết tủa trắng xanh hóa nâu trong không khí : FeCl2
-D2 xuất hiện kết tủa nâu đỏ : FeCl3
-D2 xuất hiện kết tủa màu lục sau tan : CrCl3
-D2 không hiện tượng : NaCl
Đúng 0
Bình luận (0)
Điện phân 200ml một dung dịch có chứa hai muối là Cu(NO3)2 và AgNO3 với cường độ dòng điện là 0,804 A, đến khi bọt khí bắt đầu thoát ra ở cực âm thì thời gian điện phàn là 2 giờ, người ta nhận thấy khối lượng cực âm tăng thêm 3,44 g. Hãy xác định nồng độ mol của mỗi muối trong dung dịch ban đầu?
2 giờ = 7200 s
Gọi thời gian điện phân muối bạc là t1
Gọi thời gian điện phân muối đồng là t2
⇒ t1 + t2 = 7200 (1)
Theo định luật Faraday:
mà mAg + mCu = 3,44 (g) ⇒ (9.t1 + 2,666.t2 ). 10-4 = 3,44 (2)
(1),(2) ⇒ t1 = 2400 (s) ⇒ mAg = 2,16 gam ⇒ nAg = 0,02
t2 = 4800 (s) ⇒ mCu = 1,28 gam ⇒ nCu = 0,02
CM Cu(NO3)2 = 0,02/0,2 = 0,1M ; CM AgNO3 = 0,02/0,2 = 0,1 M
Đúng 2
Bình luận (0)
Câu 30: Sục V lít khí CO2 (đktc) vào 100ml dd Ba(OH)2 có pH=14 tạo thành 3,94 gam kết tủa. Tìm giá trị của V?
Xem chi tiết
Câu 29: Cho V chất khí CO2 (đktc) vào dd Ca(OH)2 thấy tạo ra 20g chất kết tủa, đun nóng nước lọc còn lại thấy xuất hiện thêm 10g kết tủa nữa. Tính V?
Xem chi tiết
Theo đề bài, p/ứ tạo 2 muối
PTHH: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\) (1)
\(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\) (2)
\(Ca\left(HCO_3\right)_2\underrightarrow{t^o}CaCO_3\downarrow+CO_2\uparrow+H_2O\) (3)
Ta có: \(\left\{{}\begin{matrix}n_{CO_2\left(1\right)}=n_{CaCO_3\left(1\right)}=\dfrac{20}{100}=0,2\left(mol\right)\\n_{CO_2\left(2\right)}=2n_{CaCO_3\left(3\right)}=2\cdot\dfrac{10}{100}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{CO_2}=0,4\left(mol\right)\) \(\Rightarrow V_{CO_2}=0,4\cdot22,4=8,96\left(l\right)\)
Đúng 1
Bình luận (1)
Câu 28: Cho 16,8 lít CO2 (đkc) hấp thụ hoàn toàn vào 9 lít dd Ba(OH)2 0,05M. Khối lượng kết tủa thủ được là?
Xem chi tiết
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\\n_{Ba\left(OH\right)_2}=9\cdot0,05=0,45\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3\downarrow+H_2O\) (1)
\(2CO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HCO_3\right)_2\) (2)
Đặt \(\left\{{}\begin{matrix}n_{Ba\left(OH\right)_2\left(1\right)}=n_{BaCO_3}=a\left(mol\right)\\n_{Ba\left(OH\right)_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,45\\a+2b=0,75\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=n_{BaCO_3}=0,15\left(mol\right)\\b=0,3\end{matrix}\right.\)
\(\Rightarrow m_{BaCO_3}=0,15\cdot197=29,55\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 27: Sục 2,24 lít CO2 (đktc) vào 500ml dd Ba(OH)2 0,3M, sau pư thu được m gam kết tủa. Tính giá trị của m.
Xem chi tiết
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,5\cdot0,3=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
Vì Ba(OH)2 dư nên tính theo CO2
\(\Rightarrow n_{BaCO_3}=0,1\left(mol\right)\) \(\Rightarrow m_{BaCO_3}=0,1\cdot197=19,7\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 26: Cho 0,672 lít khí CO2 (đktc) vào 200ml dd Ca(OH)2 0,1M. Tính khối lượng kết tủa tạo thành.
Xem chi tiết
Ta có: \(\left\{{}\begin{matrix}n_{Ca\left(OH\right)_2}=0,2\cdot0,1=0,02\left(mol\right)\\n_{CO_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo cả 2 muối
PTHH: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\) (1)
\(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\) (2)
Đặt \(\left\{{}\begin{matrix}n_{Ca\left(OH\right)_2\left(1\right)}=n_{CaCO_3}=a\left(mol\right)\\n_{Ca\left(OH\right)_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,02\\a+2b=0,03\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=n_{CaCO_3}=0,01\left(mol\right)\\b=0,01\end{matrix}\right.\)
\(\Rightarrow m_{CaCO_3}=0,01\cdot100=1\left(g\right)\)
Đúng 1
Bình luận (0)