1.ethylene khác alkene chỗ nào?
Bài 43: Bài thực hành 5
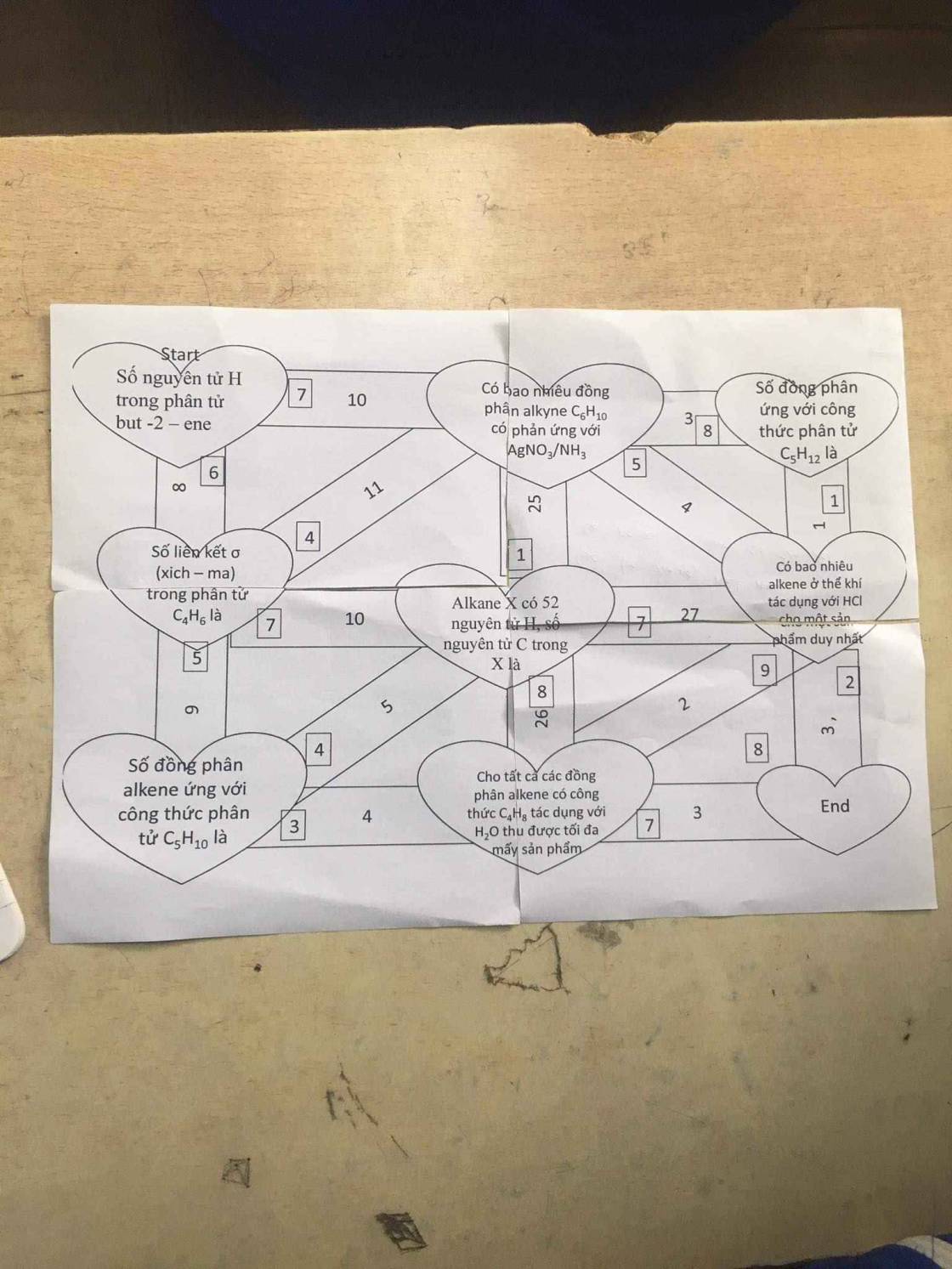
1. alkene X có 52 nguyên tử H, số nguyên tử C trong X là
alkene có CT : \(C_nH_{2n}\left(n\ge2\right)\)
\(2n=52\rightarrow n=26\)
alkene X có 52 nguyên tử H và 26 nguyên tử C
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 0,366g hợp chất hữu cơ A thu được 0,792g CO2 và 0,234g H2O. phân hủy 0,549g chất đó thu được 37,42cm3 N2 (27°C và 750mmHg). Phân tử của A chứa một nguyên tử nitơ. Xđ CTPT của A Giúp em vs ạ
Tham khảo:
Xét phản ứng đốt cháy 0,366 gam hợp chất A:
nCO2=0,79244=0,018mol
nH2O=0,23418=0,013mol
Bảo toàn nguyên tố C,HC,H:
nC=nCO2=0,018molnH=2nH2O=0,026mol
→ Trong 0,548 gam chất đó có:
nC=0,018⋅0,5490,366=0,027molnH=0,026⋅0,5490,366=0,039mol
Đổi:
37,42cm3=0,03742lit750mmHg=0,986842atm
Ta có:
nN2=PV/RT=0,986842.0,03742/0,082.(27+273)=1,5.10−3mol
Ta có:
mC+mH+mN=0,027.12+0,039.1+1,5.10−3.28=0,405gam→mO=0,549−0,405=0,144gam→nO=9.10−3mol
C:H:O:N=0,027:0,039:0,009:0,003=9:13:3:1
Mặt khác, phân tử A chỉ chứa một nguyên tố NN, nên công thức phân tử của A là:
C9H13NO3
Đúng 1
Bình luận (1)
Đốt cháy hoàn toàn 1,16g hợp chất hữu cơ X gồm C,H, O thu được 1344ml CO2 và 1,08g H2O. Cứ 2,9g của X làm bay hơi chiếm V=V của 1,3g C2H2 trong cùng điều kiện . Tìm CTPT X
\(n_{CO_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
=> nC = 0,06 (mol)
\(n_{H_2O}=\dfrac{1,08}{18}=0,06\left(mol\right)\)
=> nH = 0,12 (mol)
\(n_O=\dfrac{1,16-0,06.12-0,12.1}{16}=0,02\left(mol\right)\)
\(n_{C_2H_2}=\dfrac{1,3}{26}=0,05\left(mol\right)\)
=> \(n_X=0,05\left(mol\right)\)
=> \(M_X=\dfrac{2,9}{0,05}=58\left(g/mol\right)\)
Xét nC : nH : nO = 0,06 : 0,12 : 0,02 = 3 : 6 : 1
=> CTPT: (C3H6O)n
Mà MX = 58 g/mol
=> n = 1
=> CTPT: C3H6O
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 10,3g chất hữu cơ X thu được 17,6g CO2 ; 8,1g H2O và 1,12 lít khí N2 (đktc) . xđ CTPT của X , biết tỉ khối hơi của X so với H2 bằng 51,5
Mn giúp mk với ạ. Em cảm ơn
\(n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)\)
=> nC = 0,4 (mol)
\(n_{H_2O}=\dfrac{8,1}{18}=0,45\left(mol\right)\)
=> nH = 0,9 (mol)
\(n_{N_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
=> nN = 0,1 (mol)
\(n_O=\dfrac{10,3-0,4.12-0,9.1-0,1.14}{16}=0,2\left(mol\right)\)
Xét nC : nH : nO : nN = 0,4 : 0,9 : 0,2 : 0,1 = 4 : 9 : 2 : 1
=> CTPT: (C4H9O2N)n
Mà MX = 51,5.2 = 103 g/mol
=> n = 1
=> CTPT: C4H9O2N
Đúng 2
Bình luận (0)