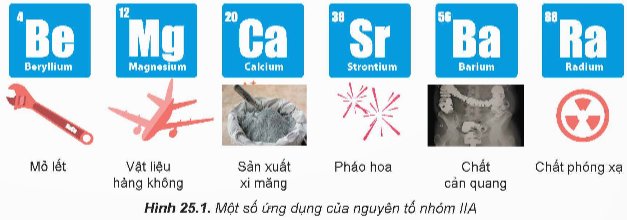
Trong nhóm IIA, magnesium và calcium là hai nguyên tố phổ biến nhất, đồng thời có vai trò quan trọng với sự sinh trưởng, phát triển của động vật và thực vật. Magnesium có trong chất diệp lục, calcium có trong vỏ và mai các loài giáp xác, trong xương và răng của người và động vật,...
Ngoài ra, đơn chất và hợp chất nhóm IIA có nhiều ứng dụng phổ biến trong đời sống, sản xuất. Vậy, đơn chất nhóm IIA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất phổ biến của calcium có vai trò như thế nào với đời sống, sản xuất và cơ thể con người?

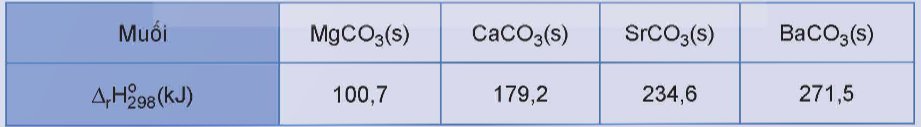
Tính chất vật lý của các nguyên tố nhóm IIA
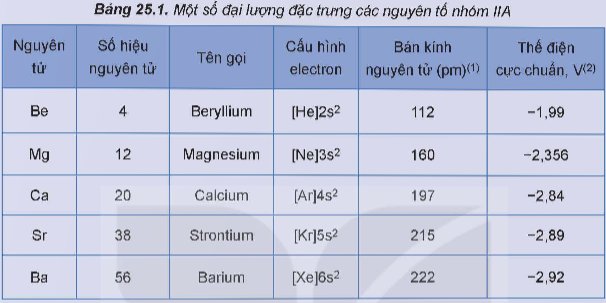
Kích thước nguyên tử: Các nguyên tố nhóm IIA có kích thước nguyên tử lớn hơn các nguyên tố nhóm IA cùng kỳ.
Tính chất kim loại: Chúng đều là kim loại có ánh kim, dễ uốn, và dẫn điện tốt.
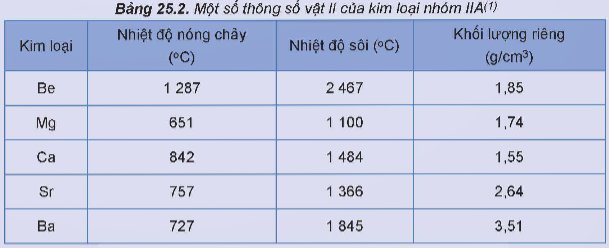
Điểm nóng chảy và điểm sôi: Chúng có điểm nóng chảy và điểm sôi cao hơn so với các kim loại kiềm (nhóm IA), nhưng vẫn thấp hơn so với nhiều kim loại khác.
Tính chất hóa học của các nguyên tố nhóm IIA
Tính kiềm: Các nguyên tố nhóm IIA có tính kiềm mạnh, nhưng kém hơn so với các nguyên tố nhóm IA. Chúng dễ dàng phản ứng với nước để tạo ra các hydroxide kiềm thổ.
Tính oxi hóa: Chúng dễ dàng bị oxi hóa và thường tồn tại ở dạng ion dương 2 (ví dụ: Ca²⁺, Mg²⁺).
Phản ứng với oxy: Các nguyên tố nhóm IIA phản ứng với oxy để tạo thành oxit, ví dụ, canxi oxit (CaO) hoặc magie oxit (MgO).
Phản ứng với acid: Chúng phản ứng với acid để tạo ra muối và khí hydro, ví dụ: Mg + 2HCl → MgCl₂ + H₂.
Trả lời bởi RAVG416