Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời?
Bài 11: Liên kết hydrogen và tương tác Van der Waals
H24
Hướng dẫn giải
Thảo luận (2)
H24
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Hướng dẫn giải
Thảo luận (1)
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực ngược dấu
Trả lời bởi Mai Trung Hải Phong
H24
Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
Hướng dẫn giải
Thảo luận (1)
Do H2O có liên kết Hidro còn H2S không có nên nhiệt độ sôi của H2O cao hơn H2S.
Trả lời bởi Trịnh Long
H24
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
Hướng dẫn giải
Thảo luận (1)
Nên tránh ướp lạnh các lon bia, nước giải khát, … trong ngăn đá của tủ lạnh vì:
Khi cho vào ngăn đá tủ lạnh, nước chuyển từ trạng thái lỏng thành trạng thái rắn. Ở trạng thái rắn nước có cấu trúc tinh thể phân tử với bốn phân tử H2O phân bố ở bốn đỉnh của một tứ diện đều, bên trong là cấu trúc rỗng.
⇒ Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng.
⇒ Có thể làm biến dạng các lon bia, nước giải khát dẫn đến nổ.
Trả lời bởi GV Nguyễn Trần Thành Đạt
H24
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
Hướng dẫn giải
Thảo luận (1)
- Phân tử NH3 có khả năng liên kết hydrogen liên phân tử do N có độ âm điện cao
- Phân tử CH4 không có khả năng liên kết hydrogen liên phân tử do C có độ âm điện thấp
=> Phân tử NH3 có nhiệt độ sôi cao hơn và khả năng hòa tan trong nước tốt hơn soi với CH4
Trả lời bởi Mai Trung Hải Phong
H24
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
Hướng dẫn giải
Thảo luận (1)
H24
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Hướng dẫn giải
Thảo luận (1)
Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm
Ví dụ:
- Nguyên tử O cần nhận thêm 2 electron => Bỏ ra 2 electron để góp chung
- Nguyên tử Cl và H cần nhận thêm 1 electron => Mỗi nguyên tử bỏ ra 1 electron để góp chung
- Nguyên tử N cần nhận thêm 3 electron => Bỏ ra 3 electron để góp chung
Trả lời bởi Mai Trung Hải Phong
H24
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Đọc tiếp
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Hướng dẫn giải
Thảo luận (1)
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị
Trả lời bởi Mai Trung Hải Phong
H24
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?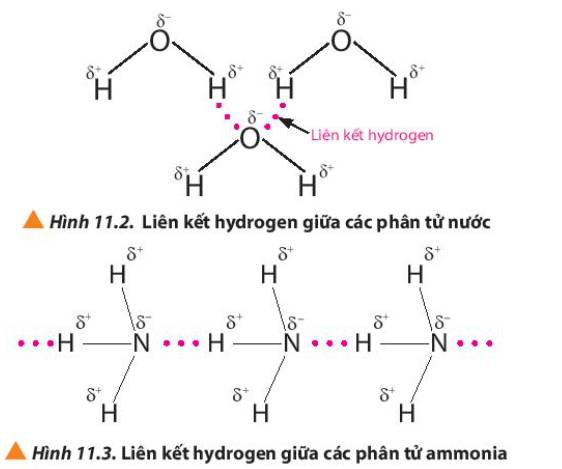
Hướng dẫn giải
Thảo luận (1)
Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Trả lời bởi Mai Trung Hải Phong
H24
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác.
Hướng dẫn giải
Thảo luận (1)
- Trong phân tử nước có 2 nguyên tử H liên kết với O => 2 nguyên tử H này tham gia liên kết hydrogen với 2 nguyên tử O của 2 phân tử nước khác
- Nguyên tử O còn 2 cặp electron hóa trị chưa tham gia liên kết => Mỗi cặp electron hóa trị sẽ liên kết hydrogen với nguyên tử H của phân tử nước khác
=> Một phân tử nước có thể tạo được liên kết hydrogen tối đa với 4 phân tử nước
Trả lời bởi Mai Trung Hải Phong
Trong phân tử, các electron chuyển động không ngừng
=> Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lượng cực tạm thời, bên nào tập trung nhiều electron hơn thì mang điện tích âm và ngược lại
Trả lời bởi Mai Trung Hải Phong