a) H2SO4 có tính acid mạnh hơn H3PO4
=> Phản ứng không xảy ra
b) H2CO3 có tính acid yếu hơn HNO3
=> Phản ứng xảy ra:
HNO3 + Na2CO3 → NaNO3 + H2O + CO2
a) H2SO4 có tính acid mạnh hơn H3PO4
=> Phản ứng không xảy ra
b) H2CO3 có tính acid yếu hơn HNO3
=> Phản ứng xảy ra:
HNO3 + Na2CO3 → NaNO3 + H2O + CO2
Al(OH)3 thể hiện tính acid, tính base trong phản ứng nào trong ví dụ trên?
Cặp electron liên kết của phân tử H2 có bị lệch về nguyên tử nào không? Vì sao?
Những đặc trưng nào sau đây thuộc về kim loại nhóm A, những đặc trưng nào thuộc về phi kim?
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
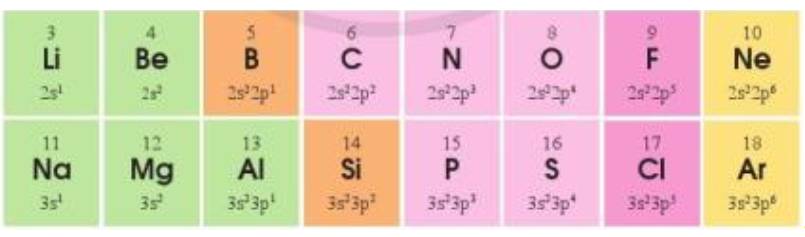
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất.
Hãy giải thích vì sao nguyên tử He là nguyên tử nguyên tố có kích thước nhỏ nhất trong bảng tuần hoàn mà không phải nguyên tử H.
Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi.
Không dùng bảng độ âm điện, hãy so sánh độ âm điện của nguyên tố X có Z = 14 và nguyên tố Y có Z = 16. Giải thích.
Sắp xếp các nguyên tố sau theo chiều tăng dần tính phi kim: O, S, F. Giải thích.
Giải thích nguyên nhân của quy luật biến đổi tính phi kim trong một chu kì, một nhóm.