Khi thêm một lượng khí CO vào hệ cân bằng, cân bằng chuyển dịch theo chiều làm giảm lượng CO, nghĩa là cân bằng chuyển dịch theo chiều nghịch.
Bài 1. Khái niệm về cân bằng hóa học
Đúng 0
Bình luận (0)
Các câu hỏi tương tự
Xét các hệ cân bằng sau trong một bình kín:a) {{rm{Delta }}_{rm{r}}}{rm{H}}_{{rm{298}}}^{rm{0}} 131 kJb) {{rm{Delta }}_{rm{r}}}{rm{H}}_{{rm{298}}}^{rm{0}} -41 kJCác cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau?(1) Tăng nhiệt độ.(2) Thêm lượng hơi nước vào hệ.(3) Thêm khí H2, vào hệ.(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.(5) Dùng chất xúc tác.
Đọc tiếp
Xét các hệ cân bằng sau trong một bình kín:
a) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)= 131 kJ
b) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)= -41 kJ
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau?
(1) Tăng nhiệt độ.
(2) Thêm lượng hơi nước vào hệ.
(3) Thêm khí H2, vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
(5) Dùng chất xúc tác.
Từ hiện tượng ở thí nghiệm 1, cho biết khi làm lạnh bình (2) và làm nóng bình (3) thì cân bằng trong mỗi bình chuyển dịch theo chiều tỏa nhiệt hay thu nhiệt.
Khi đun nóng, phản ứng trong bình (1) chuyển dịch theo chiều nào?

Nêu hiện tượng xảy ra trong Thí nghiệm 1, từ đó cho biết chiều chuyển dịch cân bằng của phản ứng trong bình 2 và bình 3.
Cho hệ cân bằng sau:
2SO2(g) + O2(g) → 2SO3(g)
Viết biểu thức tính hằng số cân bằng KC của phản ứng trên.
Cho phản ứng sau:
COCl2(g) ⇌ CO(g) + Cl2(g) KC = 8,2 x 10-2 (900K)
Ở trạng thái cân bằng, nếu nồng độ CO và Cl2 đều bằng 0,15M thì nồng độ COCl2 là bao nhiêu?
Yếu tố nào sau đây luôn luôn khônglàm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ. B. Áp suất. C. Nồng độ. D. Chất xúc tác.
Dựa vào phương trình hóa học của phản ứng điều chế khí oxygen từ KMnO4, em hãy cho biết phản ứng có xảy ra theo chiều ngược lại được không?
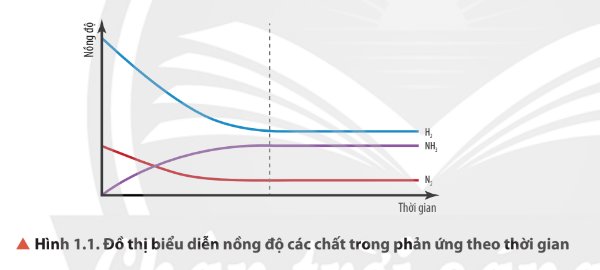
Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).