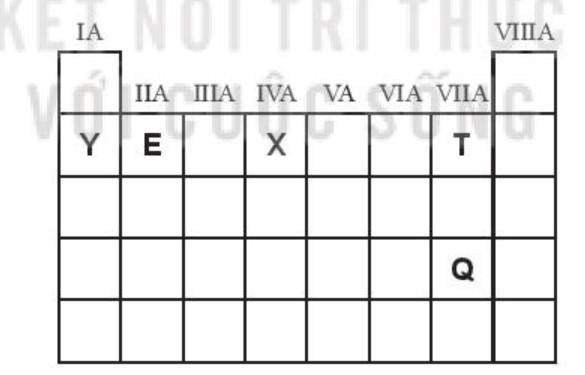
Cho vị trí của các nguyên tố E, T, Q, X, Y trong bảng tuần hoàn rút gọn (chỉ biểu diễn các nguyên tố nhóm A) như sau:
Có các nhận xét sau:
(1) Thứ tự giảm dần tính kim loại Y, E, X.
(2) Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Thứ tự giảm dần tính phi kim là T, Q.
(4) Thứ tự giảm dần bán kính nguyên tử là Y, E, X, T.
Số nhận xét đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Chọn D
(1): Y,E,X tăng dần theo số nhóm
=>Nó sẽ giảm dần tính kim loại
(2): Y,X,T nó tăng dần theo điện tích hạt nhân nguyên tử
=>Độ âm điện tăng dần
(3); Theo chiều tăng của điện tích hạt nhân thì tính phi kim tăng dần
=>Thứ tự giảm dần là T,Q là đúng
(4): trong 1 chu kì bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử
=>Thứ tự giảm dần là Y,E,X,T
Trả lời bởi Nguyễn Lê Phước Thịnh