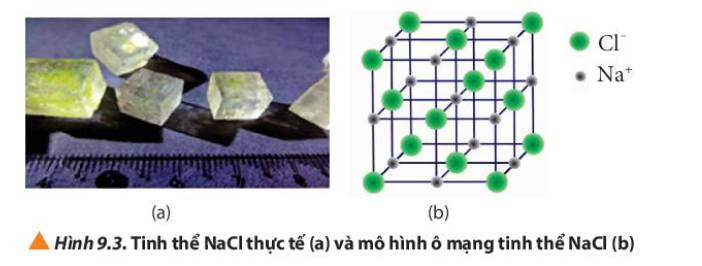
Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất

Em hiểu thế nào về tinh thể ion?
- Tinh thể ion là hợp chất ion
- Các ion liên kết với nhau nhờ lực hút tĩnh điện tạo thành hợp chất ion
Trả lời bởi Mai Trung Hải PhongTrong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích.
- Các nguyên tố kim loại dễ nhường electron => Tạo thành cation
- Các nguyên tố phi kim dễ nhận electron => Tạo thành anion
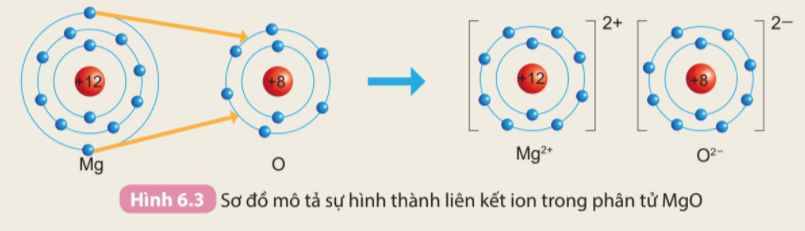
Trả lời bởi Mai Trung Hải PhongTrình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen.
- Nguyên tử Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp ngoài cùng
=> Có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion Mg2+
- Nguyên tử O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng
=> Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
=> Nguyên tử O sẽ nhận 2 electron của nguyên tử Mg tạo thành 2 ion Mg2+ và O2-. 2 ion liên kết với nhau tạo thành phân tử MgO
Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine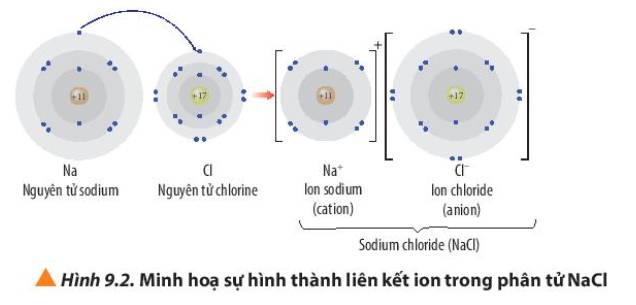
Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không? Chúng có cấu hình electron giống cấu hình electron nguyên tử của nguyên tố nào?
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học
- Ion O2- có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học
Trả lời bởi Mai Trung Hải PhongQuan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của mỗi ion tạo thành.
- Ion sodium: có 10 electron ở lớp vỏ và 11 proton trong hạt nhân
- Ion oxide: có 10 electron ở lớp vỏ và 8 proton trong hạt nhân
Trả lời bởi Mai Trung Hải PhongHơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Trong đó, thường gặp nhất là các muối hydrochloride, sodium hoặc sulfate.
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?

- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình
Trả lời bởi Mai Trung Hải PhongTrình bày cách tính điện tích của các ion thu được khi nguyên tử nhường hoặc nhận thêm electron trong Hình 9.1
- Các tích điện tích của ion thu được khi nguyên tử nhường hoặc nhận thêm electron:
Điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion
- Ví dụ:
+ Ion sodium: điện tích = 11 – 10 = 1 => Điện tích là +1
+ Ion oxide: điện tích = 8 – 10 = -2 => Điện tích là -2
Trả lời bởi Mai Trung Hải PhongCác ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron của khí hiếm Ne
- Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron => Giống cấu hình electron của khí hiếm Ar
Trả lời bởi Mai Trung Hải Phong
a) Tinh thể NaCl có cấu trúc là hình lập phương
b) Các ion Na+ và Cl- được xếp xen kẽ nhau
c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất.
Ví dụ: xung quanh ion Na+ có 6 ion Cl-
Trả lời bởi Mai Trung Hải Phong