Quan sát nhóm VIIIB trong bảng tuần hoàn, cho biết nhóm này có đặc điểm gì khác biệt so với các nhóm còn lại.
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
H24
Hướng dẫn giải
Thảo luận (2)
H24
Quan sát Hình 5.5, nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử với số thứ tự nhóm của nguyên tố nhóm A.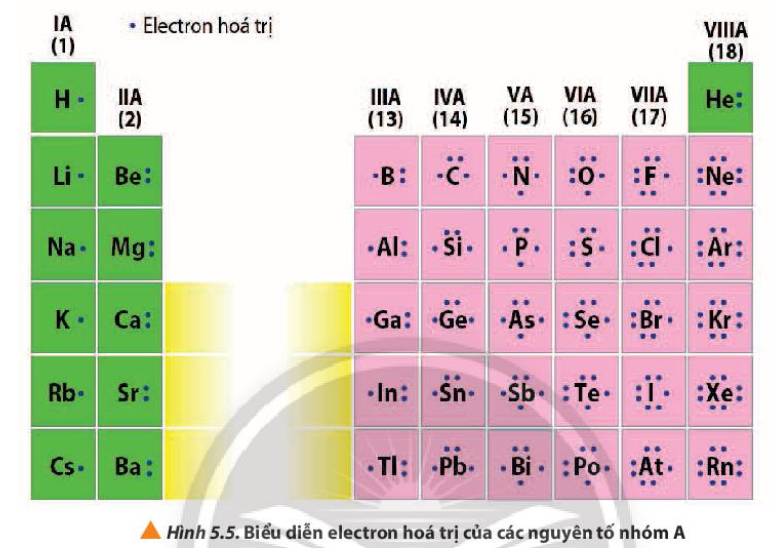
Hướng dẫn giải
Thảo luận (1)
- Số electron hóa trị của nguyên tử = số thứ tự nhóm của nguyên tố nhóm A
Ví dụ:
+ Nhóm IA, các nguyên tố đều có 1 electron hóa trị
+ Nhóm IIIA, các nguyên tố đều có 3 electron hóa trị
+ Nhóm VIIIA (trừ He) các nguyên tố đều có 8 electron hóa trị
Trả lời bởi GV Nguyễn Trần Thành Đạt
H24
Quan sát Hình 5.2, dựa vào cấu hình electron nguyên tử, hãy nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử các nguyên tố với số thứ tự nhóm của nguyên tố nhóm B. Nêu rõ các trường hợp đặc biệt.
Hướng dẫn giải
Thảo luận (2)
Electron hóa trị thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
Trả lời bởi Mai Trung Hải Phong
H24
Dựa vào cấu hình electron, cho biết nguyên tố có số hiệu nguyên tử là 6, 8, 18, 20 thuộc khối nguyên tố nào trong bảng tuần hoàn. Chúng là kim loại, phi kim hay khí hiếm?
Hướng dẫn giải
Thảo luận (1)
`Z=6 ->C` (là phi kim)
`Z=8 ->O` (là phi kim)
`Z=18 ->Ar` (là khi hiếm)
`Z=20 ->Ca` (là kim loại)
Trả lời bởi 2611
H24
Nitrogen là thành phần dinh dưỡng cần thiết cho sự sinh trưởng, phát triển và sinh sản của thực vật. Biết nitrogen có số hiệu nguyên tử là 7.
a) Viết cấu hình electron của nitrogen
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Hướng dẫn giải
Thảo luận (1)
`a)` Cấu hình electron: `1s^2 2s^2 2p^3 .`
`b)` Nitrongen là nguyên tố `p.`
`c)` Nitrongen là phi kim.
Trả lời bởi 2611
H24
Quan sát Hình 5.2, nhận xét chiều tăng điện tích hạt nhân nguyên tử các nguyên tố trong chu kì và nhóm.
Hướng dẫn giải
Thảo luận (1)
Các nguyên tố hóa học được xếp theo chiều tăng điện tích hạt nhân nguyên tử các nguyên tố trong chu kì và nhóm.
+ Trong một chu kì: điện tích hạt nhân tăng theo chiều từ trái sang phải;
+ Trong một nhóm: điện tích hạt nhân tăng theo chiều từ trên xuống dưới.
Trả lời bởi GV Nguyễn Trần Thành Đạt
H24
Silicon là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ. Xác định vị trí của nguyên tố silicon (Z 14) trong bảng tuần hoàn.
Đọc tiếp
Silicon là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ. Xác định vị trí của nguyên tố silicon (Z = 14) trong bảng tuần hoàn.
Hướng dẫn giải
Thảo luận (1)
H24
Viết cấu hình electron nguyên tử và xác định vị trí của các nguyên tố sau trong bảng tuần hoàn. Cho biết chúng thuộc khối nguyên tố nào (s, p, d, f) và chúng là kim loại, phi kim hay khí hiếm:a) Neon tạo ra ánh sáng màu đỏ khi sử dụng trong các ống phóng điện chân không, được sử dụng rộng rãi trong các biển quảng cáo. Cho biết Ne có số hiệu nguyên tử là 10.b) Magnesium được sử dụng để làm cho hợp kim bền nhẹ, đặc biệt được ứng dụng cho ngành công nghiệp hàng không. Cho biết Mg có số hiệu nguyên...
Đọc tiếp
Viết cấu hình electron nguyên tử và xác định vị trí của các nguyên tố sau trong bảng tuần hoàn. Cho biết chúng thuộc khối nguyên tố nào (s, p, d, f) và chúng là kim loại, phi kim hay khí hiếm:
a) Neon tạo ra ánh sáng màu đỏ khi sử dụng trong các ống phóng điện chân không, được sử dụng rộng rãi trong các biển quảng cáo. Cho biết Ne có số hiệu nguyên tử là 10.
b) Magnesium được sử dụng để làm cho hợp kim bền nhẹ, đặc biệt được ứng dụng cho ngành công nghiệp hàng không. Cho biết Mg có số hiệu nguyên tử là 12.
Hướng dẫn giải
Thảo luận (1)
`a)` Cấu hình electron của Neon là: `1s^2 2s^2 2p^6`
`=>Ne in ` khối nguyên tố `p` và là khí hiếm.
`b)` Cấu hình electron của Magnesiem là: `1s^2 2s^2 2p^6 3s^2`
`=>Mg in` khối nguyên tố `s` và là kim loại.
Trả lời bởi 2611
H24
Dãy nào gồm các nguyên tố có tính chất hóa học tương tự nhau? Vì sao?
a) Oxygen (Z = 8), nitrogen (Z = 7), carbon (Z = 6)
b) Lithium (Z = 3), sodium (Z = 11), potassium (Z = 19)
c) Helium (Z = 2), neon (Z = 10), argon (Z = 18)
Hướng dẫn giải
Thảo luận (1)
Lithium (Z = 3), sodium (Z = 11), potassium (Z = 19) cùng thuộc nhóm IA nên có tính chất hóa học tương tự nhau.
Trả lời bởi Phía sau một cô gái
H24
Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA
b) Nguyên tố khí hiếm thuộc chu kì 3
Hướng dẫn giải
Thảo luận (1)
`a)` Cấu hình electron: `1s^2 2s^2 2p^6 3s^2 3p^6 4s^2`
`b)` Cấu hình electron: `1s^2 2s^2 2p^6 3s^2 3p^6 3d^[10] 4s^2`
Trả lời bởi 2611
Trong bảng tuần hoàn, mỗi nhóm chỉ có 1 cột riêng nhóm VIIIB có đến 3 cột.
Trả lời bởi Mai Trung Hải Phong