Có 4 kim loại: A, B, C, D đứng sau Mg trong dãy hoạt động hoá học. Biết rằng :
a) A và B tác dụng với dung dịch HCl giải phóng khí hiđro.
b) C và D không có phản ứng với dung dịch HCl.
c) B tác dụng với dung dịch muối của A và giải phóng A.
d) D tác dụng được với dung dịch muối của C và giải phóng C.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hoá học giảm dần):
a) B, D, C, A; b) D, A, B, C ;
c) B, A, D, C ; d) A...
Đọc tiếp
Có 4 kim loại: A, B, C, D đứng sau Mg trong dãy hoạt động hoá học. Biết rằng :
a) A và B tác dụng với dung dịch HCl giải phóng khí hiđro.
b) C và D không có phản ứng với dung dịch HCl.
c) B tác dụng với dung dịch muối của A và giải phóng A.
d) D tác dụng được với dung dịch muối của C và giải phóng C.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hoá học giảm dần):
a) B, D, C, A; b) D, A, B, C ;
c) B, A, D, C ; d) A, B, C, D ; e) C, B, D, A.
a) 4Na + O2 → 2Na2O
2Cu + O2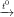 2CuO
2CuO
b) 2Fe + 3Cl2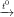 2FeCl3
2FeCl3
2Al + 3S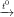 Al2S3
Al2S3
c) Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O
Fe + 2HCl → FeCl2 + H2
d) Fe + CuSO4 → Cu + FeSO4
Cu + 2AgN03 2Ag + Cu(NO3)2
Trả lời bởi Đặng Phương Nam