Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao
(c) Thường tồn tại ở thể rắn trong điều kiện thường
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp
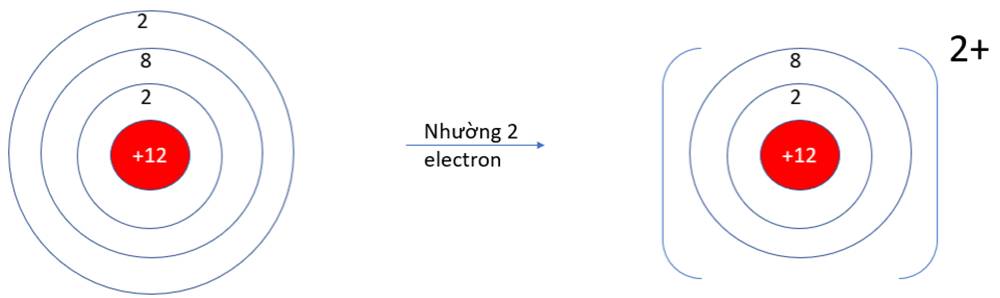
Đặc điểm hợp chất ion:
+ Các hợp chất ion thường là tinh thể rắn ở điều kiện thường
+ Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao
=> Phát biểu (b) và (c) đúng
Trả lời bởi Hà Quang Minh