Quan sát hiện tượng tự nhiên sau:
Viên bi rơi từ trên cao (vị trí có năng lượng cao hơn) xuống dưới đất (vị trí có năng lượng thấp hơn) mà không tự lăn theo chiều ngược lại.
Hãy cho biết quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (năng lượng thấp hơn) hay kém bền hơn (năng lượng cao hơn)

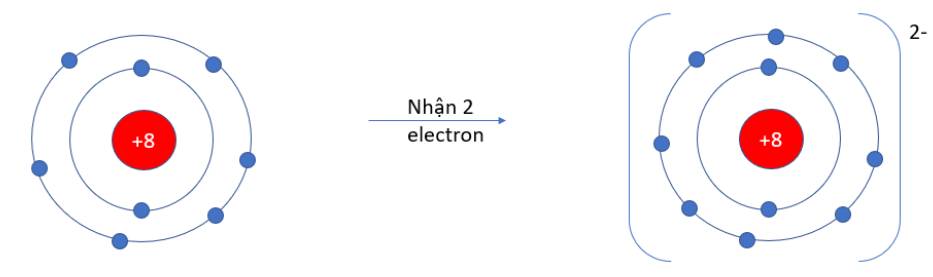
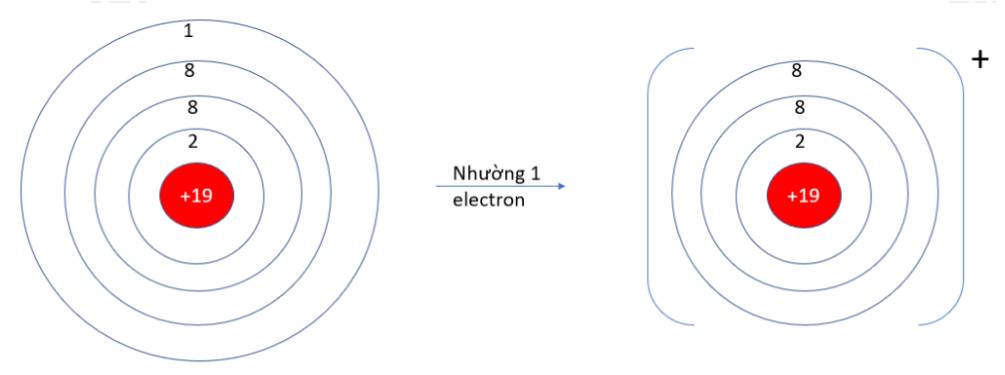

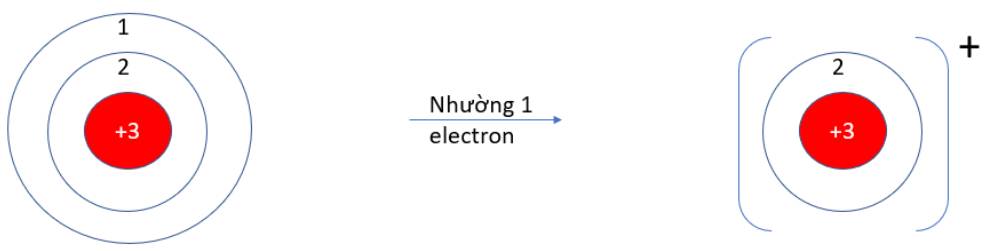
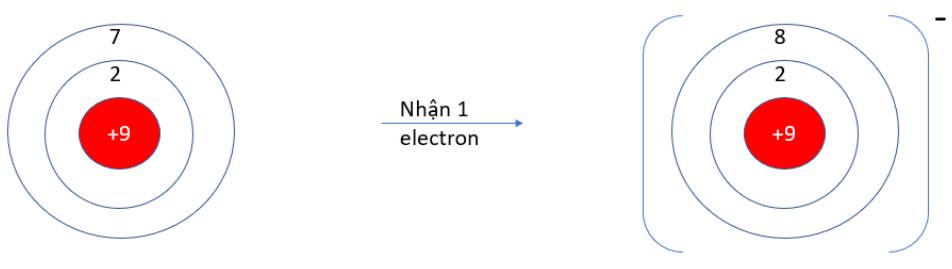
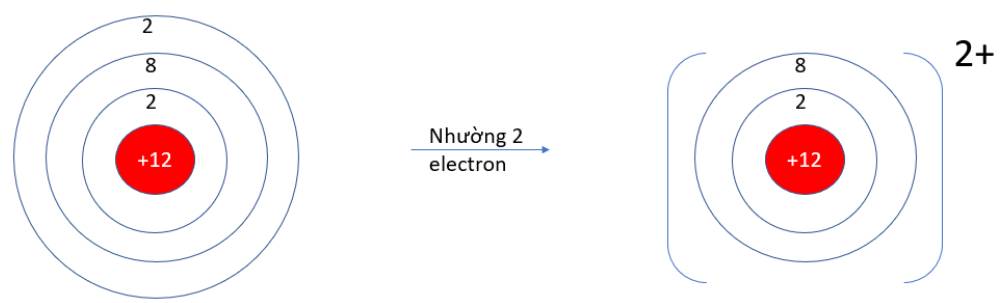
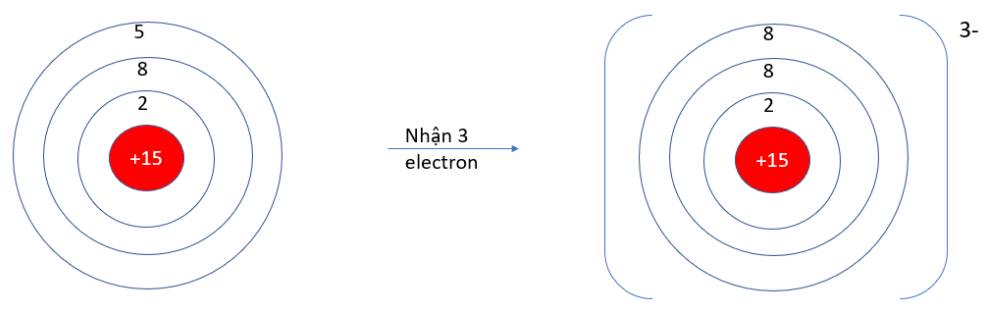
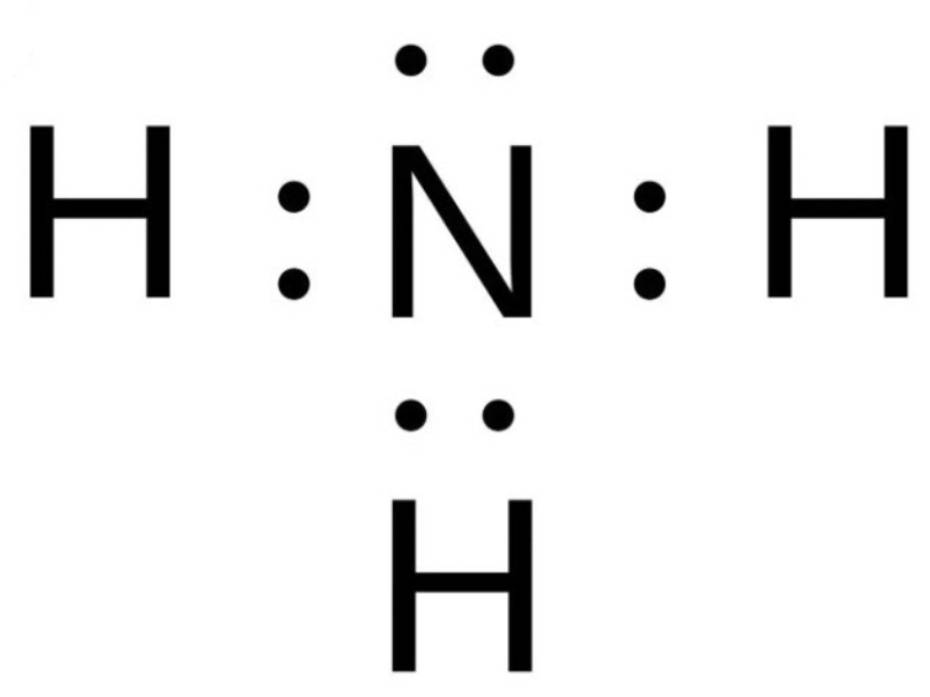
Viên bi có xu hướng dịch chuyển từ nơi có năng lượng cao hơn (kém bền) về nơi có năng lượng thấp hơn (bền hơn)
=> Như vậy quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (nơi có có năng lượng thấp hơn)
Trả lời bởi Hà Quang Minh