Bài 4. Đơn chất Nitrogen
Nội dung lý thuyết
Các phiên bản khácI. Trạng thái tự nhiên của nguyên tố nitrogen
- Nguyên tố nitrogen có kí hiệu hóa học là N, số hiệu nguyên tử là 7, độ âm điện là 3,04.
- Trong tự nhiên, nitrogen tồn tại đồng thời ở cả dạng đơn chất và hợp chất.
+ Trong khí quyển, nitrogen tồn tại chủ yếu dưới dạng đơn chất N2, chiếm khoảng 78% thể tích không khí.
+ Trong nước và đất, nitrogen tồn tại chủ yếu dưới dạng ion nitrate (\(NO_3^-\)), nitrite (\(NO_2^-\)) và ammonium (\(NH_4^+\)).
+ Nguyên tố nitrogen có trong cơ thể của mọi sinh vật chủ yếu ở dạng các hợp chất hữu cơ như amino acid, nucleic acid, protein, chlorophyll (chất diệp lục),... Các hợp chất này đóng vai trò quan trọng trong những quá trình sinh hóa của sinh vật.
II. Đơn chất nitrogen
1. Đặc điểm liên kết
- Phân tử N2 có liên kết ba giữa hai nguyên tử nitrogen, cả hai nguyên tử này đều thỏa mãn quy tắc octet với công thức Lewis như sau:

2. Tính chất cơ bản
a) Tính kém hoạt động hóa học (tính trơ) ở nhiệt độ thấp
- Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ/mol) nên rất khó bị phá vỡ. Vì vậy, ở nhiệt độ và áp suất thường, nitrogen rất khó tham gia phản ứng.
- Đặc điểm này được gọi là tính kém hoạt động hóa học hay tính trơ của đơn chất nitrogen.
b) Tính hoạt động hóa học ở nhiệt độ cao
- Phản ứng của nitrogen và hydrogen diễn ra thuận nghịch, được thực hiện ở điều kiện nhiệt độ và áp suất khá cao cùng với chất xúc tác là bột sắt.
\(N_2\left(g\right)+3H_2\left(g\right)\overset{t^o,p,xt}{⇌}2NH_3\left(g\right)\) \(\Delta_rH^o=-91,8kJ\)
- Nitrogen phản ứng với oxygen ở nhiệt độ rất cao, khoảng 3000oC, tạo ra nitrogen monoxide (NO).
\(N_2\left(g\right)+O_2\left(g\right)\overset{t^o}{⇌}2NO\left(g\right)\) \(\Delta_rH^o=180,6kJ\)
- Trong khí quyển, phản ứng này chính là sự khởi đầu cho quá trình tạo thành ion nitrate (\(NO_3^-\)), được coi là một nguồn cung cấp đạm cho đất. Trước tiên, nitrogen monoxide được tạo thành từ nitrogen và oxygen khi có sấm sét. Sau đó, nitrogen monoxide nhanh chóng bị oxi hóa bởi oxiygen trong khí quyển tạo thành nitrogen dioxide (NO2). Tiếp theo là quá trình nitrogen dioxide chuyển thành acid trong nước mưa. Nước mưa với nồng độ acid phù hợp sẽ giúp cung cấp đạm cho đất ở dạng ion nitrate cần thiết cho cây trồng.
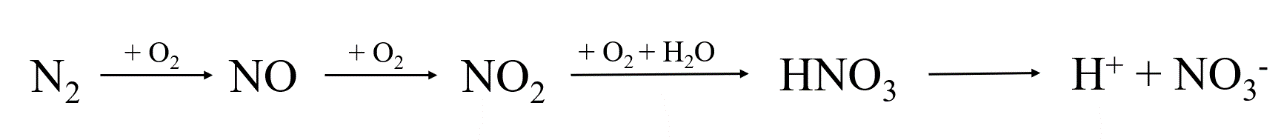
3. Ứng dụng
Mỗi năm có hàng triệu tấn nitrogen được sản xuất trên toàn cầu; trong đó, lượng nitrogen dạng khí chiếm khoảng hai phần ba, còn lại là nitrogen lỏng.
- Vì tính chất kém hoạt động hóa học (tính trơ), nitrogen không oxi hóa các chất khác ở nhiệt độ thường. Dựa vào tính chất này, người ta thường dùng khí nitrogen để thay thế hoàn toàn hoặc một phần không khí trong rất nhiều trường hợp khác nhau để giảm nguy cơ cháy nổ, giảm quá trình oxi hóa do oxygen trong không khi gây nên.
- Nitrogen hóa lỏng ở nhiệt độ thấp, -196oC nên được sử dụng để làm lạnh nhanh, bảo quản thực phẩm ngay tại nhà máy và trong quá trình vận chuyển hoặc sử dụng để đóng băng và kiểm soát dòng chảy trong các đường ống.
- Trong lĩnh vực sinh học và y học, các mẫu vật sinh học được bảo quản trong bình nitrogen lỏng. Bình này thường có hai khoang: khoang chứa nitrogen lỏng cùng ống chứa mẫu vật cần bảo quản và khoang chân không để cách nhiệt với bên ngoài.
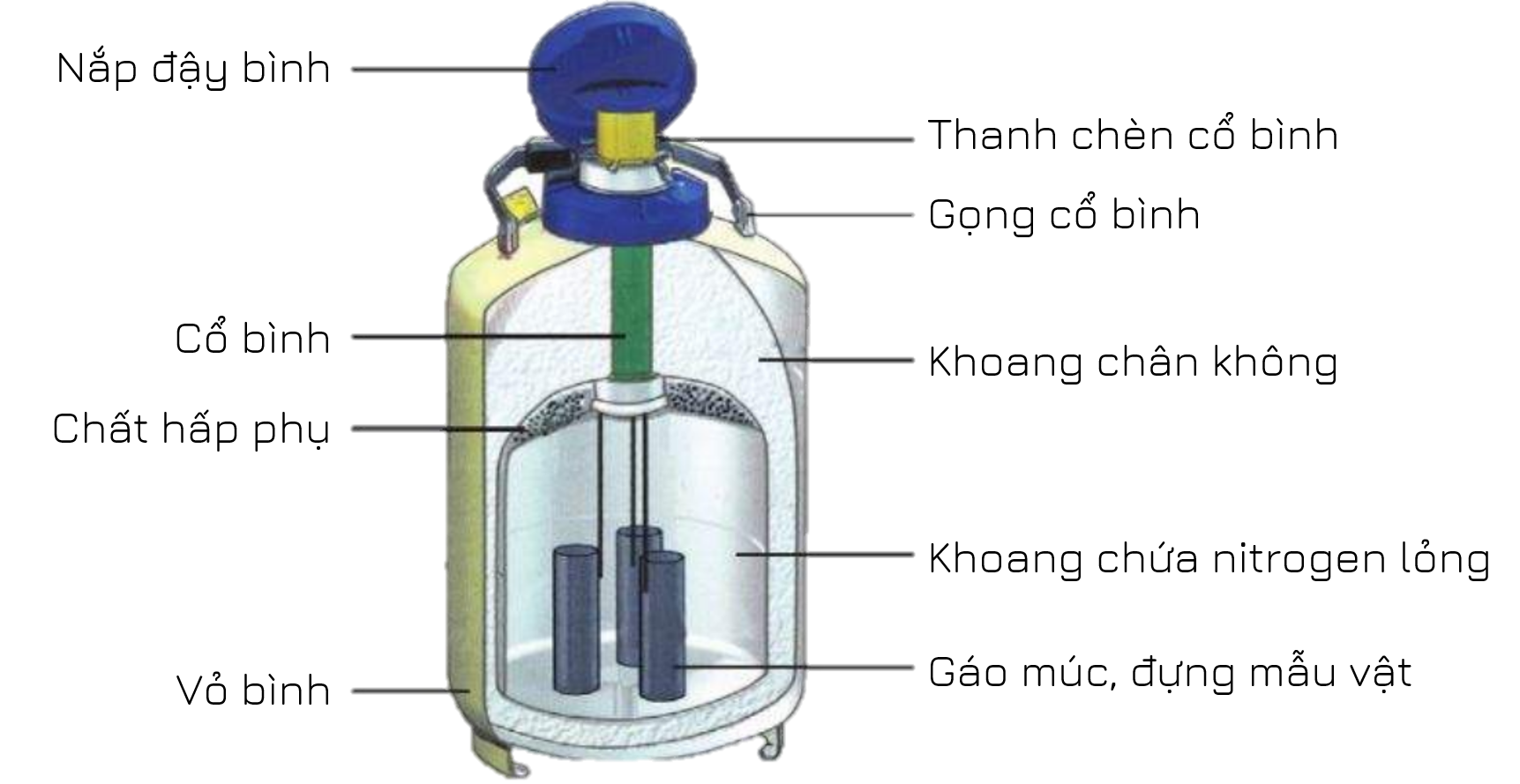
Lưu ý: nitrogen lỏng có thể gây bỏng lạnh khi tiếp xúc.
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| Đức Hiếu đã đóng góp một phiên bản khác cho bài học này (16 tháng 8 2023 lúc 19:26) | 0 lượt thích |